
【题目】工业上制取氯酸钾的主要步骤为:
I.将Cl2通入石灰浆,在75℃左右充分反应,然后过滤;
II.向滤液中加入稍过量的KCl固体,进行适当操作可析出KClO3固体。
请回答下列问题:
(1)步骤I中总反应的化学方程式为6Ca(OH)2+ 6Cl2=Ca(ClO3)2+5CaCl2+ 6H2O 。
①标出反应中电子转移的方向和数目______________。
②滤液中Ca(ClO3)2与CaC12的物质的量之比n[Ca(ClO3)2]:n [CaCl2]____l∶5 (填“> ”“< ”、或“=” ) ,理由是___________。
(2)下图是有关物质的溶解度曲线。步骤II中,若溶液中KClO3的含量为147g·L-1,则KClO3得物质的量浓度为_______________。从该溶液中尽可能多地析出KClO3 固体的方法是______________。

【答案】 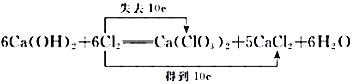 < 同时还发生反应 2Ca(OH)2+ 2C12=Ca(ClO)2+CaCl2+ 2H2O 1. 2 mol L-1 蒸发浓缩、冷却结晶
< 同时还发生反应 2Ca(OH)2+ 2C12=Ca(ClO)2+CaCl2+ 2H2O 1. 2 mol L-1 蒸发浓缩、冷却结晶
【解析】(1)①反应6Ca(OH)2+ 6Cl2=Ca(ClO3)2+5CaCl2+ 6H2O中只有Cl元素化合价发生变化,由0价分别变化为+5价、-1价,氯气既是氧化剂也是还原剂,由方程式可知反应6mol氯气时生成1mol Ca(ClO3)2,转移10mol电子,则表示子转移的方向和数目为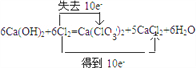 ;②部分氯气与冷的氢氧化钙反应2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,也生成氯化钙,所以n[Ca(ClO3)2]:n [CaCl2]<l:5;(2)若溶液中KClO3的含量为147g·L-1,则1L溶液中含有KClO3的物质的量是147g÷122.5g/mol=1.2mol,因此物质的量浓度为1.2mol/L。由于氯酸钾的溶解度随温度升高而增大,所以该溶液中尽可能多地析出KClO3固体的操作应该是蒸发浓缩、冷却结晶。
;②部分氯气与冷的氢氧化钙反应2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,也生成氯化钙,所以n[Ca(ClO3)2]:n [CaCl2]<l:5;(2)若溶液中KClO3的含量为147g·L-1,则1L溶液中含有KClO3的物质的量是147g÷122.5g/mol=1.2mol,因此物质的量浓度为1.2mol/L。由于氯酸钾的溶解度随温度升高而增大,所以该溶液中尽可能多地析出KClO3固体的操作应该是蒸发浓缩、冷却结晶。


科目:高中化学 来源: 题型:
【题目】化学与生活息息相关,下列说法不正确的是
A.淀粉、纤维素均属于糖类
B.油脂属于天然有机高分子
C.蛋白质的变性属于不可逆转的过程
D.新鲜蔬菜和水果富含维生素C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 通过化学变化可以实现16O与18O之间的转化
B. 因为H2O的沸点高于H2S,所以O原子得电子能力大于S原子
C. 某化合物熔融状态下能导电,该化合物中一定有离子键
D. 化学键是相邻分子之间的强烈的相互作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解CuCl2和NaCl的混合溶液,阴极和阳极上分别析出的物质是( )
A. H2和Cl2 B. Cu和Cl2 C. H2和O2 D. Cu和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在原电池领域应用广泛,试回答下列问题:
(1)下边装置溶液中的Ag+向___________(填“铁电极”或“石墨电极”)移动,写出该电极的电极反应式:_______________________________。
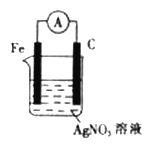
(2)请依据反应:2Fe3++Fe==3Fe2+设计一个原电池。要求:写出电极反应式,画出实验装置图,注明电解质溶液、正负极及正负极所用的材料______________________。
正极反应式:_______________________________。负极反应式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。能表明反应达到平衡状态的叙述是
Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。能表明反应达到平衡状态的叙述是
A. Fe3O4的物质的量不变 B. V(H2O)=V(H2)
C. 反应不再进行 D. 容器内压强不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com