
【题目】研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为_____________。利用反应6NO2+ 8NH3![]() 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是________L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是________L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol
2NO2(g) ΔH=-113.0 kJ·mol
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=_____________kJ·mol-1。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
SO3(g)+NO(g)的ΔH=_____________kJ·mol-1。一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a 体系压强保持不变 b 混合气体颜色保持不变
c SO3和NO的体积比保持不变 d 每消耗1 mol SO3的同时生成1 molNO2
该温度下,此反应的平衡常数表达式K=__________。
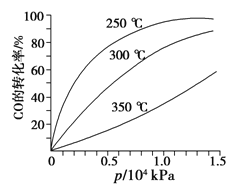
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH______0(填“>”或“ <”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH______0(填“>”或“ <”)。
【答案】3NO2+H2O=NO+2HNO3 6.72 -41.8 b K=c(SO3).c(NO)/[c(NO2).c(SO2)] <
【解析】
(1)NO2可用水吸收生成硝酸和一氧化氮。由关系式NO2 ~4e-,结合V=n×Vm计算可得;
(2)由盖斯定律计算ΔH。判断平衡状态紧抓“逆向相等,变量不变”的特征。平衡常数等于可逆化学反应达到平衡状态时生成物与反应物的浓度(方程式系数幂次方)乘积比或反应产物与反应底物的浓度(方程式系数幂次方)乘积比;
(3)由图像可知,压强相同时,温度越大,CO的平衡转化率越小,平衡正向移动。
(1)NO2可用水吸收生成硝酸和一氧化氮,相应的化学反应方程式为3NO2+H2O=NO+2HNO3。反应6NO2+ 8NH3![]() 7N2+12 H2O中,NO2 化合价由+4→0,得到4e-,现在转移1.2mole-,即NO2 得到1.2mole-,所以n(NO2 )=1.2mol/4=0.3mol,所以标况下V(NO2)=0.3mol×22.4L/mol=6.72L;
7N2+12 H2O中,NO2 化合价由+4→0,得到4e-,现在转移1.2mole-,即NO2 得到1.2mole-,所以n(NO2 )=1.2mol/4=0.3mol,所以标况下V(NO2)=0.3mol×22.4L/mol=6.72L;
(2)反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)可以由已知方程式(①-②)/2得到,所以ΔH=(ΔH1-ΔH2)/2=-41.8 kJ·mol-1。
SO3(g)+NO(g)可以由已知方程式(①-②)/2得到,所以ΔH=(ΔH1-ΔH2)/2=-41.8 kJ·mol-1。
a. 该反应前后气体分子数不变,所以反应前后压强始终不变,压强不变不能判断达平衡,故a错误;
b. 反应物NO2 呈红棕色,随着反应进行NO2 不断变化,颜色不断变化,当不变时,NO2浓度不变可以说明达到平衡,故b正确;
c. 生成物SO3:NO始终等于1:1,所以体积比不随反应而改变,不能判定达平衡,故c错误;
d.每消耗1 mol SO3的同时生成1molNO2 不能表示正反应速率等于逆反应速率,不能判定达平衡,故d错误;
答案选b。
平衡常数等于可逆化学反应达到平衡状态时生成物与反应物的浓度(方程式系数幂次方)乘积比或反应产物与反应底物的浓度(方程式系数幂次方)乘积比,则该温度下,此反应的平衡常数表达式K=c(SO3).c(NO)/[c(NO2).c(SO2)];
(3)由图像可知,压强相同时,温度越大,CO的平衡转化率越小,所以升温对正反应不利,正反应是个放热反应,ΔH<0。


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏德罗常数,下列叙述正确的是 ( )
A. 标准状况下,22.4LH2O含有的分子数为1 NA
B. 常温常压下,16g O2含有的原子数为1 NA
C. 通常状况下,1NA 个SO2分子占有的体积约为22.4L
D. 物质的量浓度为0.5mol/L的K2SO4溶液中,含有SO42-个数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代工业的发展导致CO2的大量排放,对环境造成的影响日益严重,通过各国科技工作者的努力,已经开发出许多将CO2回收利用的技术,其中催化转化法最具应用价值。回答下列问题:
(1)在催化转化法回收利用CO2的过程中,可能涉及以下化学反应:
①CO2(g)+2H2O(1)![]() CH3OH(1)+
CH3OH(1)+![]() O2(g) △H=+727kJ·mol-1 △G=+703kJ·mol-1
O2(g) △H=+727kJ·mol-1 △G=+703kJ·mol-1
②CO2(g)+2H2O(1)![]() CH4(g)+2O2(g) △H=+890kJ·mol-1 △G=+818kJ·mol-1
CH4(g)+2O2(g) △H=+890kJ·mol-1 △G=+818kJ·mol-1
③CO2(g)+3H2(g)![]() CH3OH(1)+H2O(1) △H=-131kJ·mol-1 △G=-9.35kJ·mol-1
CH3OH(1)+H2O(1) △H=-131kJ·mol-1 △G=-9.35kJ·mol-1
④CO2(g)+4H2(g)![]() CH4(g)+2H2O(1) △H=-253kJ·mol-1 △G=-130kJ·mol-1
CH4(g)+2H2O(1) △H=-253kJ·mol-1 △G=-130kJ·mol-1
从化学平衡的角度来看,上述化学反应中反应进行程度最小的是____,反应进行程度最大的是_____。
(2)反应CO2(g)+4H2(g)=CH4(g) +2H2O(g)称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
①在载人航天器中利用Sabatier反应实现回收CO2再生O2,其反应过程如图所示,这种方法再生O2的最大缺点是需要不断补充_________(填化学式)。

②在1.5 MPa,气体流速为20 mL·min-l时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如下:
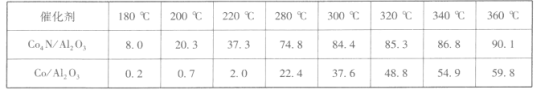
分析上表数据可知:_____(填化学式)的催化性能更好。
③调整气体流速,研究其对某一催化剂催化效率的影响,得到CO2的转化率(%)如下:
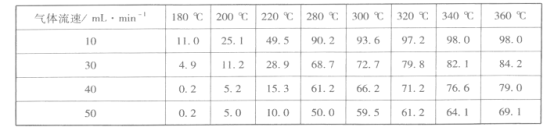
分析上表数据可知:相同温度时,随着气体流速增加,CO2的转化率____(填“增大”或“减小”),其可能的原因是_________________________________。
④在上述实验条件中,Sabatier反应最可能达到化学平衡状态的温度是____,已知初始反应气体中V(H2):V(CO2) =4:l,估算该温度下的平衡常数为 ___________(列出计算表达式)。
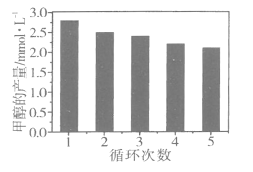
(3)通过改变催化剂可以改变CO2与H2反应催化转化的产物,如利用Co/C作为催化剂,反应后可以得到含有少量甲酸的甲醇。为了研究催化剂的稳定性,将Co/C催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇的产量如图所示,试推测甲醇产量变化的原因_________________________________。(已知Co的性质与Fe相似)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国圣路易斯大学研制了一种新型的乙醇电池,其反应为:C2H5OH+3O2→ 2CO2+3H2O,电池示意如右图,下列说法正确的是
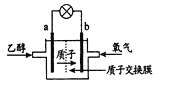
A. a极为电池的正极
B. b极发生氧化反应
C. 负极的反应为:4H++O2+4e-===2H2O
D. 电池工作时,1mol乙醇被氧化时有12mol转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
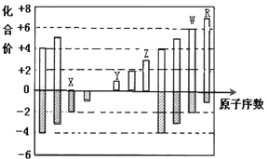
A. 原子半径:Z>Y>X
B. Y和Z两者最高价氧化物对应水化物能相互反应
C. WX3和水反应形成的化合物是离子化合物
D. 气态氢化物的稳定性:R<W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种重要的基本化工原料,其分子中碳元素的百分含量为85.7%,且相对分子量小于30。A、B、C、D、E、F、G、H有下图所示的转化关系(部分产物已略去)。其中B为高分子化合物,C为无色无味气体,实验室中可以通过G与大理石制取。D为烃,不能使酸性高锰酸钾溶液褪色。E、G为生活中常见的有机物,且E有特殊香味,H有香味。
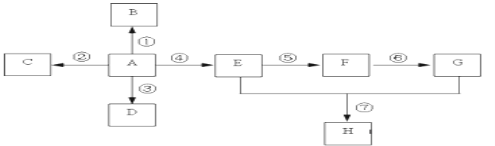
(1)写出下列各物质的官能团的名称:A ___________;E ___________;
(2)按要求写出下列各步变化的化学方程式
反应①__________________;
反应⑤_____________________;
反应⑦ _______________________。
(3)写出下列反应类型:反应④___________,反应⑤___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的混合气体,在密闭容器中发生如下反应:xA(g)+yB(g)![]() zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,当恒温下将密闭容器的容积扩大到两倍再达到平衡后,测得A浓度为0.3 mol·L-1,则下列叙述正确的是
zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,当恒温下将密闭容器的容积扩大到两倍再达到平衡后,测得A浓度为0.3 mol·L-1,则下列叙述正确的是
A. 平衡向正反应方向移动 B. x+y<z
C. C 的体积分数降低 D. B的转化率提高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质溶于水的电离方程式:
HNO3:________________________________________________________;
NH3H2O:_____________________________________________________;
(2)按要求写出方程式。
①铁和稀硫酸(写出离子方程式)_________________________________________;
②氢氧化钡溶液和稀硫酸(写出离子方程式)_______________________________;
③氧化铜和稀盐酸(写出离子方程式)_____________________________________;
④制备氢氧化铁胶体(写出对应的化学方程式)_____________________________;
⑤CO32-+2H+=CO2↑+H2O(写出对应的化学方程式)_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 298 K时,2H2S(g)+SO2(g)===3S(s)+2H2O(l)能自发进行,则其ΔH>0
B. 氨水稀释后,溶液中c(NH4+)/c(NH3·H2O)的值减小
C. 电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等
D. 25℃时Ka(HClO)=3.0×108,Ka(HCN)=4.9×1010,若该温度下NaClO溶液与NaCN溶液的pH相同,则c(NaClO)>c(NaCN)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com