【答案】
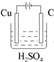
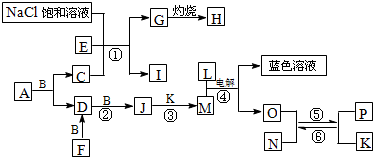
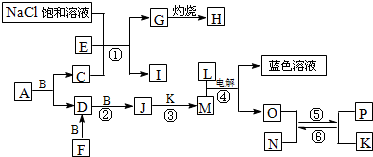
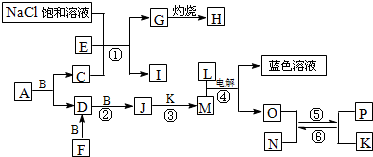
分析:已知A是一种有机溶剂,F是一种黄色粉末结合转化关系推断为S,N有磁性判断为Fe
3O
4;B、F、L、O、P是中学化学常见单质;A和B反应前后气体体积(常温常压)保持不变;在试管中灼烧固体I,试管底部无固体残留推断为NH
4Cl;反应①②③均是化工生产中的重要反应,推断反应①是工业侯德榜制碱发的反应,E,C为NH
3,CO
2;G为NaHCO
3,H为Na
2CO
3;依据F+B=D,D+B=J,J的相对分子质量比D大16;说明B为O
2,D为SO
2,J为SO
3,推断M为H
2SO
4,K为H
2O,L为单质,L+M(H
2SO
4)电解得到蓝色溶液,和O,说明L为Cu,M为硫酸,电解得到的溶液是硫酸铜溶液,说明此反应是以铜为电极电解硫酸溶液,生成的O为H
2,分析题意结合N有磁性判断为Fe
3O
4;确定P为Fe,判断结合A是一种有机溶剂含有硫元素,A和B反应前后气体体积(常温常压)保持不变,推断为CS
2,C为CO
2,E为NH
3,综上所述得到:各物质为A为CS
2,B为O
2,C为CO
2,D为SO
2,E为NH
3,F为S,G为NaHCO
3,H为Na
2CO
3,I为NH
4Cl,J为SO
3,K为H
2O,L为Cu,M为H
2SO
4,N为Fe
3O
4,O为H
2,P为Fe;依据判断物质分析回答问题;
解答:解:已知A是一种有机溶剂,F是一种黄色粉末结合转化关系推断为S,N有磁性判断为Fe
3O
4;B、F、L、O、P是中学化学常见单质;A和B反应前后气体体积(常温常压)保持不变;在试管中灼烧固体I,试管底部无固体残留推断为NH
4Cl;反应①②③均是化工生产中的重要反应,推断反应①是工业侯德榜制碱发生的反应,E,C为NH
3,CO
2;G为NaHCO
3,H为Na
2CO
3;依据F+B=D,D+B=J,J的相对分子质量比D大16;说明B为O
2,D为SO
2,J为SO
3,推断M为H
2SO
4,K为H
2O,L为单质,L+M(H
2SO
4)电解得到蓝色溶液,和O,说明L为Cu,M为硫酸,电解得到的溶液是硫酸铜溶液,说明此反应是以铜为电极电解硫酸溶液,生成的O为H
2,分析题意结合N有磁性判断为Fe
3O
4;确定P为Fe,判断结合A是一种有机溶剂含有硫元素,A和B反应前后气体体积(常温常压)保持不变,推断为CS
2,C为CO
2,E为NH
3,综上所述得到:各物质为A为CS
2,B为O
2,C为CO
2,D为SO
2,E为NH
3,F为S,G为NaHCO
3,H为Na
2CO
3,I为NH
4Cl,J为SO
3,K为H
2O,L为Cu,M为H
2SO
4,N为Fe
3O
4,O为H
2,P为Fe;
(1)依据分析判断C为CO
2,电子式为:
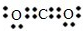
;故答案为:

;
(2)A(CS
2)与B(O
2)反应生成二氧化碳和二氧化硫,反应的化学方程式为:CS
2+3O
2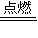
CO
2+2SO
2;
故答案为:CS
2+3O
2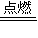
CO
2+2SO
2;
(3)反应①是工业侯德榜制碱发生的反应,反应的化学方程式为:NaCl+NH
3+CO
2+H
2O=NaHCO
3↓+NH
4Cl;故答案为:NaCl+NH
3+CO
2+H
2O=NaHCO
3↓+NH
4Cl;
(4)反应④是以铜做电极电解稀硫酸溶液,阳极铜失电子形成铜离子,阴极氢离子得到电子形成氢气,反应的离子方程式为:Cu+2H
+ 
Cu
2++H
2↑;
故答案为:Cu+2H
+ 
Cu
2++H
2↑;
(5)高温下由反应⑤为Fe
3O
4+4H
2
3Fe+4H
2O,生成6molP为Fe,依据化合价变化计算,反应时共转移电子为16mol,故答案为:16
点评:本题考查了物质转化关系应用,物质心中的分析判断,反应条件和反应现象的应用,主要是工业制备反应的熟练掌握,侯德榜制碱方法是判断的突破,题目难度较大.


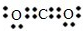 ;故答案为:
;故答案为: ;
; CO2+2SO2;
CO2+2SO2; CO2+2SO2;
CO2+2SO2; Cu2++H2↑;
Cu2++H2↑; Cu2++H2↑;
Cu2++H2↑;  3Fe+4H2O,生成6molP为Fe,依据化合价变化计算,反应时共转移电子为16mol,故答案为:16
3Fe+4H2O,生成6molP为Fe,依据化合价变化计算,反应时共转移电子为16mol,故答案为:16


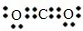
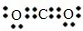

 Fe3O4+4H2
Fe3O4+4H2 Fe3O4+4H2
Fe3O4+4H2