
下列有关能量的判断或表示方法正确的是( )
A.由C(s,石墨)===C(s,金刚石) ΔH=+1.9 kJ·mol-1,可知:石墨比金刚石更稳定
B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多
C.由H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,可知:含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ
D.2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ·mol-1
科目:高中化学 来源: 题型:
某化学实验小组用下图所示装置制取氯气,下列说法不正确的是
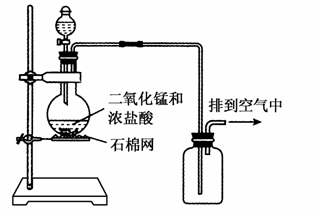
A.该装置图中存在两处明显错误
B.该实验装置中收集氯气的方法不正确
C.为了防止氯气污染空气,必须进行尾气处理
D.在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以检验是否有氯气逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)25 ℃、101 kPa时,1 g甲醇完全燃烧生成CO2和液态水,放出22.68 kJ热量,则该反应的热化学方程式为________________________________________。
(2)0.3 mol气态高能燃料乙硼烷(B2H6)在O2中燃烧,生成固态B2O3和液态水,放出649.5 kJ热量,则该反应的热化学方程式为_____________
___________________________________________________________。
(3)肼(N2H4)是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量,则肼燃烧的热化学方程式为______
_______________________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将1.5 g两种金属的混合物粉末与足量的稀盐酸反应,反应完全后,得到标准状况下的氢气1.12 L,则两种金属可能是( )
A.Fe和Cu B.Zn和Cu
C.Al和Fe D.Mg和Al
查看答案和解析>>
科目:高中化学 来源: 题型:
物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D、E为单质,试回答:
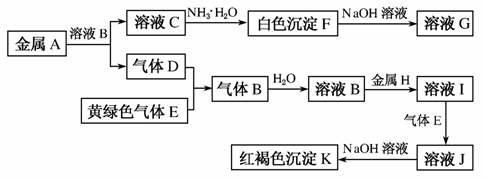
(1)写出下列物质的化学式:A________,B________,D________,K________。
(2)写出反应“C→F”的离子方程式:____________________________________________________________________________。
(3)写出反应“F→G”的化学方程式:__________________________________________________________________________________。
(4)写出反应“J→K”的离子方程式:__________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:
mCeO2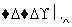 (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+xCO2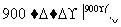 mCeO2+xH2+xCO
mCeO2+xH2+xCO
下列说法不正确的是( )
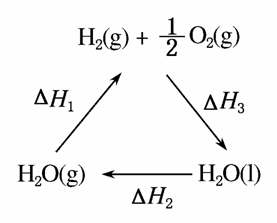
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
C.右图中ΔH1=ΔH2+ΔH3
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-===CO +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.合成纤维和光导纤维都是新型无机非金属材料
B.4.0g NaOH固体中所含分子数为0.1NA(NA表示阿伏加德罗常数的值)
C.纯碱、烧碱、漂白粉都属于盐类
D.Cl2使湿的红色布条褪色是因为HClO有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
I2O5是白色固体,遇水生成碘酸(HIO3)。I2O5可用于检验并定量测定空气中的CO,在常温下发生的反应为 5CO+I2O5=5CO2+I2 (空气中其余气体不与I2O5反应)。
实验一:制取I2O5
将碘酸加热至90~110 ºC使其部分脱水,再升温至220~240 ℃并恒温4 h,使反应完全。接着慢慢冷却至室温,密封保存,即得五氧化二碘。
(1)写出碘酸制I2O5的化学方程式: 。
(2)在制得的I2O5固体中含有少量I2杂质,提纯的方法是 (填标号);
A.过滤 B.蒸发结晶 C.蒸馏 D.升华
该提纯方法用到的玻璃仪器为 (填标号)。
A.圆底烧瓶 B.烧杯 C.普通漏斗 D.酒精灯 E.玻璃棒
实验二:检验空气中CO
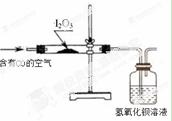 利用右图装置检验空气中是否存在CO。
利用右图装置检验空气中是否存在CO。
(3)能说明空气中含有CO的现象是 。
(4)倘若要从广口瓶中出现浑浊来判断空气中含有CO,请写出改进的实验方案: 。
实验三:测定空气中CO的含量
(5)将I2O5与CO反应生成的碘单质用硫代硫酸钠滴定(反应为I2+2Na2S2O3=Na2S4O6+2NaI),即可根据消耗硫代硫酸钠的量来计算空气中CO的含量。若某次实验时测得参与反应的空气体积为a mL(标准状况下),滴定过程中,共消耗v mL c mol·L-1 Na2S2O3溶液。则该空气样品中CO的体积分数是 。
(6)该实验方案存在的一个明显缺陷是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义。
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。已知:
①CO(g)+ O2(g)====CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)====CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+ O2(g)==== SO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是_________________________。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:①CO(g)+NO2(g)====NO(g)+CO2(g) ΔH=-akJ·mol-1(a>0)
②2CO(g)+2NO(g)= ===N2(g)+
===N2(g)+ 2C
2C O2(g) ΔH=-bkJ·
O2(g) ΔH=-bkJ· mol-1(b>0)
mol-1(b>0)
若用标准状况下3.36 L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为________mol,放出的热量为________kJ(用含有a和b的代数式表示)。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)====4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1①
②CH4(g)+4NO(g )====2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
)====2N2(g)+CO2(g)+2H2O(g) ΔH2=?②
若1 mol CH4还原NO2至N2整个过程中放出的热量为867 kJ,则ΔH2=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com