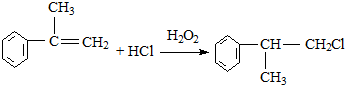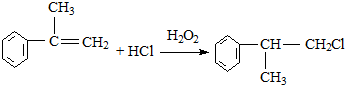(2010?揭阳一模)硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同.气体成分可能含SO
2、SO
3和O
2中的一种、二种或三种.某化学课外活动小组通过设计一探究性实验,探索测定反应产生的SO
2、SO
3和O
2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO
4分解的化学方程式.实验可能用到的仪器如图所示:

[提出猜想]
Ⅰ.所得气体的成分可能只含
SO3
SO3
一种;
Ⅱ.所得气体的成分可能含有
SO2、O2
SO2、O2
二种;
Ⅲ.所得气体的成分可能含有
SO3、SO2、O2
SO3、SO2、O2
三种.
[实验探究]
实验操作过程(略).已知实验结束时,硫酸铜完全分解.请回答下列问题:
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为:
①⑨⑩⑥⑤③④⑧⑦②
①⑨⑩⑥⑤③④⑧⑦②
(填序号)
(2)若实验结束,B中量筒没有收集到水,则证明猜想
Ⅰ
Ⅰ
正确.
(3)若实验结束,经测定装置C的总质量增加了,能否肯定气体产物中含有SO
2而不含SO
3?
请说明理由.答:
不能,因为SO3与F中的饱和NaHSO3反应会生成等物质的量的SO2
不能,因为SO3与F中的饱和NaHSO3反应会生成等物质的量的SO2
.
(4)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后,测得相关数据也不同,数据如下:
| 实验小组 |
称取CuSO4
的质量(g) |
装置C增加
的质量(g) |
量筒中水的体积折算成标
准状况下气体的体积(mL) |
| 一 |
6.4 |
2.56 |
298.7 |
| 二 |
6.4 |
2.56 |
448 |
请通过计算,推断出第一小组和第二小组的实验条件下CuSO
4分解的化学反应方程式:
一组:
3CuSO
4 3CuO+2SO
2↑+SO
3↑+O
2↑
3CuSO
4 3CuO+2SO
2↑+SO
3↑+O
2↑
;
二组:
.
(5)该实验设计中,由于实验操作的原因容易给测定带来最大误差的两个仪器是
B
B
和
E
E
(填代号).

 ;
; ;
;

 阅读快车系列答案
阅读快车系列答案 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成




 (X为卤素原子)
(X为卤素原子) 的物质,该物质是一种香料.
的物质,该物质是一种香料.