
| A. | 氢氧燃料电池在碱性介质中负极的反应式是:O2+2H2O+4e-═4OH- | |
| B. | NaHCO3在水溶液中的水解离子方程式:HCO${\;}_{3}^{-}$+H2O═CO2↑+OH- | |
| C. | 用FeS为沉淀剂除去废水中的Hg2+:FeS(s)+Hg2+(aq)═HgS(s)+Fe2+(aq) | |
| D. | 将Na2CO3在水溶液加热蒸干,由于CO2易挥发,最终得到NaOH固体 |
分析 A.负极失去电子发生氧化反应;
B.碳酸氢根水解生成碳酸和氢氧根;
C.硫化汞溶解度小于硫化亚铁,实现沉淀的转化;
D.碱性环境下不能生成酸性气体.
解答 解:A.氢氧燃料电池在碱性介质中负极的反应式是:H2+2OH--2e-═2H2O,故A错误;
B.NaHCO3在水溶液中的水解离子方程式,离子方程式:HCO3-+H2O?H2CO3+OH-,故B错误;
C.用FeS为沉淀剂除去废水中的Hg2+,离子方程式:FeS(s)+Hg2+(aq)═HgS(s)+Fe2+(aq),故C正确;
D.将Na2CO3在水溶液加热蒸干,仍然得到碳酸钠,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意盐类水解的应用、注意书写燃料电池电极反应式应考虑电解质性质,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 分子中含有3种官能团 | |
| B. | 遇FeCl3溶液呈现为紫色 | |
| C. | 1mol该物质最多可与2molNaOH发生中和反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO不溶于水,是一种大气污染物 | |
| B. | NO是一种红棕色的有毒气体 | |
| C. | NO结合血红蛋白的能力比CO还强 | |
| D. | NO与氧气反应生成NO2,体现其还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧热为285.5KJ/mol,则电解水的热化学方程式为2H2O(l)$\frac{\underline{\;电解\;}}{\;}$ 2H2(g)+O2(g)△H=+285.5KJ/mol | |
| B. | 已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ/mol 则稀H2SO4溶液和稀Ba(OH)2溶液反应的反应热△H=2×(-57.3)KJ/mol | |
| C. | 在CO2中,Mg燃烧生成MgO和C,该反应中化学能全都转化为热能 | |
| D. | 已知AX3的熔点和沸点分别为一93.6℃和76℃,AX5的熔点为167℃.室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 KJ/mol.该反应的热化学方程式为AX3(l)+X2(g)=AX5(s)△H=一123.8 KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 原子半径 | 电负性 | 第一电离能 |
| C | 67pm | 2.55 | 1125.8kJ/mol |
| S | 88pm | 2.58 | 1036.7kJ/mol |
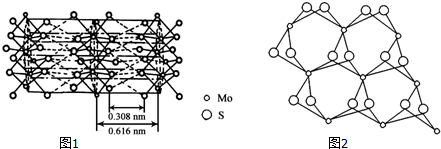
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取3.23 g NaCl固体 | |
| B. | 用10 mL 量筒量取 7.50 mL 稀盐酸 | |
| C. | 分液以后 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 | |
| D. | 粗盐提纯中除泥沙的操作顺序是:溶解、过滤、蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.| T/K | 398 | 498 |
| 平衡常数K | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由C(石墨)=C(金刚石)△H=+11.9 kJ/mol,可知金刚石比石墨稳定 | |
| B. | 等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量多 | |
| C. | 水力(水能)按不同的分类可看成可再生能源和一级能源 | |
| D. | 可表示氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com