
【题目】举世闻名的侯氏制碱法的工艺流程如下图所示,下列说法正确的是
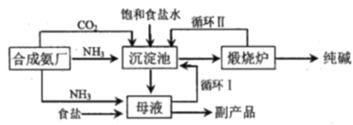
A.往母液中加入食盐的主要目的是使NaHCO3更多的析出
B.从母液中经过循环Ⅰ进入沉淀池的主要是Na2CO3、NH4Cl和氨水
C.沉淀池中反应的化学方程式:2NH3+CO2+2NaCl+H2O=2NH4Cl+Na2CO3
D.设计循环Ⅱ的目的是使原料二氧化碳利用率大大提升
【答案】BD
【解析】
根据侯氏制碱法的工艺流程,先通入氨气再通入二氧化碳反应得到碳酸氢钠晶体和含有氯化铵的母液,沉淀池中的反应方程式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,过滤得到碳酸氢钠晶体,在煅烧炉中加热分解,碳酸氢钠受热分解生成碳酸钠,过滤后的母液中通入氨气加入细小食盐颗粒,冷却析出副产品氯化铵,氯化钠溶液可以循环使用,据此分析解答。
A.向母液中通氨气可以增大NH4+的浓度,加入食盐增大氯离子,使NH4Cl更多地析出,因此往母液中加入食盐的主要目的不是使NaHCO3更多的析出,故A错误;
B.向母液中通氨气可以增大NH4+的浓度,同时使NaHCO3转化为Na2CO3,加入食盐增大氯离子,使NH4Cl更多地析出,因此从母液中经过循环Ⅰ进入沉淀池的主要是Na2CO3、NH4Cl和氨水,故B正确;
C.在沉淀池中饱和食盐水与通入的氨气和二氧化碳反应析出碳酸氢钠晶体,反应方程式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,故C错误;
D.循环Ⅰ是将未反应的氯化钠返回沉淀池中使原料氯化钠的利用率大大提升,循环Ⅱ的目的是使生成的二氧化碳通入沉淀池继续反应生成碳酸氢钠,使二氧化碳利用率大大提升,故D正确;
故选BD。


科目:高中化学 来源: 题型:
【题目】BASF高压法制备醋酸,所采用钴碘催化循环过程如图所示,则下列观点错误的是( )
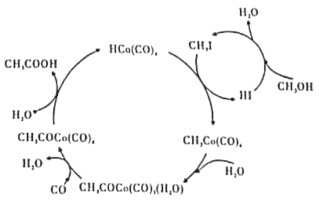
A.CH3OH转化为CH3I的有机反应类型属于取代反应
B.从总反应看,循环过程中需不断补充CH3OH、H2O、CO等
C.与乙酸乙酯互为同分异构体且与CH3COOH互为同系物的物质有2种结构
D.工业上以淀粉为原料也可以制备醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氟化氮(NF3)是无色无味的气体,它可由氨和氟直接反应得到:4NH3+3F2![]() NF3+3NH4F。下列有关NF3的叙述正确的是
NF3+3NH4F。下列有关NF3的叙述正确的是
A. NF3是离子化合物 B. NF3中的N呈+3价
C. NF3的氧化性比F2强 D. NF3的还原性比NH3强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在化学研究和工业生产中意义重大。在一定条件可发生如下两个氧化还原反应:
①Fe+ H2SO4(浓)![]() Fe2(SO4)3+ SO2↑+H2O(未配平)
Fe2(SO4)3+ SO2↑+H2O(未配平)
②3S+6KOH![]() 2K2S+ K2SO3+3H2O
2K2S+ K2SO3+3H2O
试回答下列问题:
(1)反应①中氧化产物为____________,当反应中生成标准状况下6.72LSO2气体时,被还原的H2SO4的物质的量为____________mol。
(2)反应②中,还原剂与氧化剂的物质的量之比为______________,若反应中有4.816×1023个电子发生转移时,消耗S的质量为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用X射线研究某金属晶体,测得在边长为360 pm的立方晶胞中含有4个金属原子,此时金属的密度为9.0 g/cm3。试回答下列问题:
(1)此金属晶胞属于哪一种类型?_______
(2)求每个晶胞的质量。_______
(3)求此金属的相对原子质量。_______
(4)求此金属原子的原子半径(pm)。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
A. NaHCO3水解的离子方程式:HCO3-+ H2O![]() CO32-+H3O+
CO32-+H3O+
B. NH4Cl溶于D2O中:NH4++D2O![]() NH3·HDO+D+
NH3·HDO+D+
C. Na2S显碱性原因:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
D. 向0.1mol/L、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-=A2-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置如图所示,下列说法正确的是( )
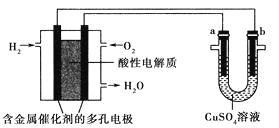
A. 燃料电池工作时,正极反应为O2+2H2O+4e-=4OH-
B. 电解精炼铜时,若转移1mol电子,a极质量减少32g
C. 铁表面镀铜时,a为铁,b为Cu,工作一段时间要使右池溶液复原可加入适量的CuO
D. 若a、b两极均为石墨时,在相同条件下,a极产生的气体与电池中消耗的O2体积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 Na2CO3 和 Na2S 按 1∶2 的物质的量之比配成溶液,再通入 SO2,可制取 Na2S2O3,同时放出CO2。在该反应中( )
A.被氧化与被还原的原子个数比为 2∶1
B.相同条件下,每吸收 1 m3 SO2 就会放出 2.5 m3 CO2
C.每 1 mol Na2S 反应,则生成的 Na2S2O3 为 1.5 mol
D.若有 106 g Na2CO3 发生反应,反应中转移的电子的物质的量为 4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于沉淀溶解平衡和溶度积常数,下列说法不正确的是( )
A. Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关
B. 将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4)
C. 已知25 ℃时Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe(OH)3+3H+![]() Fe3++3H2O的平衡常数K=4.0×104
Fe3++3H2O的平衡常数K=4.0×104
D. 已知25 ℃时Ksp[Mg(OH)2] =1.8×10-11,在MgCl2溶液中加入氨水调混合液的pH=11,产生沉淀,则此时溶液中的c(Mg2+)=1.8×10-5mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com