
| A. | 浓氨水可检验氯气管道漏气 | |
| B. | 碘是人体必需微量元素,所以要多吃富含高碘酸的食物 | |
| C. | 二氧化硫通入次氯酸钠溶液:SO2+ClO-+H2O=SO42-+Cl-+2H+ | |
| D. | 冷的NaOH溶液中通入Cl2:Cl2+2OH-═Cl-+ClO-+H2O |
分析 A、浓氨水挥发出的氨气和氯气发生氧化还原反应生成氮气和氯化铵,反应现象冒白烟;
B、碘是人体必须微量元素,每人每天大约吃食盐12克,多吃无益;
C、次氯酸根离子具有强的氧化性能够氧化亚硫酸根离子;
D、氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
解答 解:A、浓氨水挥发出的氨气和氯气发生氧化还原反应生成氮气和氯化铵,3Cl2+8NH3=N2+6NH4Cl,反应过程中现象是冒白烟,浓氨水可检验氯气管道漏气,故A正确;
B、碘是人体必需微量元素,所以要吃富含KIO3的食盐,但不能多吃,多吃会导致升高血压,促进动脉粥样硬化,故B错误;
C、二氧化硫通入次氯酸钠溶液,反应生成硫酸、氯化钠,反应的离子方程式为:SO2+ClO-+H2O=SO42-+Cl-+2H+,故C正确
D、氯气与氢氧化钠溶液反应的离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,故D正确;
故选B.
点评 本题考查了离子方程式的正误判断,明确电离方程式的书写注意问题及弱电解质的判断即可解答,题目较简单.


科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收a kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 mol A+2 mol B | B. | 3 mol C+2 mol D | ||
| C. | 1 mol B+3 mol C+1 mol D | D. | 2 mol A+1 mol B+3mol C+1 mol D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )| A. | Y单质与氢气反应较Z剧烈 | |
| B. | 最高价氧化物对应水化物酸性W比Z弱 | |
| C. | X单质氧化性强于Y单质 | |
| D. | X与W的原子核外电子数相差9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 进行蒸馏操作时冷凝管进水的方向是上进下出 | |
| B. | 用酒精萃取碘水中的碘 | |
| C. | 用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当温度一定时,不同的起始条件下可逆反应建立平衡状态时,平衡常数和转化率一定是定值 | |
| B. | 依据焓判据:NH4HCO3受热分解可自发进行 | |
| C. | 大多数化学反应在一定条件下都有一定的限度 | |
| D. | FeCl3与KSCN反应达到平衡时,向其中滴加少量KCl溶液,则溶液颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
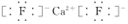 ;Y2与NaOH溶液反应的产物之一是OY2,该反应的离子方程式为2F2+2OH-=OF2↑+2F-+H2O.
;Y2与NaOH溶液反应的产物之一是OY2,该反应的离子方程式为2F2+2OH-=OF2↑+2F-+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com