
| 1 |
| 2 |
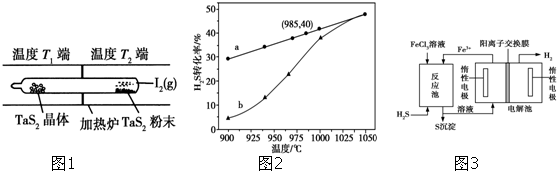
| c(TaI 4)c(S 2) |
| c 2(I 2) |
| 0.5x×0.5x |
| (1-x)2 |
| ||
| ||


科目:高中化学 来源: 题型:

| A、滤液A中的阳离子为Fe2+、Fe3+、H+ |
| B、样品中Fe元素的质量为1.12 g |
| C、样品中CuO的质量为4.0 g |
| D、V=448 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 结果分析 |
| 步骤1:取少量样品于试管中,加入适量蒸馏水使之溶解, | 若有白色沉淀生成,说明产品中含有NaCl. |
| 步骤2:另取少量样品于锥形瓶中,加入适量蒸馏水使之溶解,加入几滴酚酞,用0.1000mol?L-1盐酸滴定至溶液由红色变无色,记录消耗盐酸的体积V1. | 若 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com