
| A�� | O2��O3�ȶ�����O2��O3Ϊ���ȷ�Ӧ | |
| B�� | O3��O2�ȶ�����O2��O3Ϊ���ȷ�Ӧ | |
| C�� | ��������O2��O3�����ͣ���O2��O3Ϊ���ȷ�Ӧ | |
| D�� | ��������O2��O3�����ߣ���O2��O3Ϊ���ȷ�Ӧ |
���� ���ø�˹���ɣ�����Ӧ��-�ڵã�3O2��g��=2O3��g������H=+284.2KJ/mol����֪�������������ȳ��������ͣ����ʵ�����Խ��Խ�ȶ���ȼ������ָ1mol������������ȫȼ��ʱ�ų����������ݴ˽��
��� �⣺���ø�˹���ɣ�����Ӧ��-�ڵã�3O2��g��=2O3��g������H=+284.2KJ/mol����֪�������������ȳ��������ͣ����ʵ�����Խ��Խ�ȶ���ȼ������ָ1mol������������ȫȼ��ʱ�ų���������
AB�����ø�˹���ɣ�����Ӧ��-�ڵã�3O2��g��=2O3��g������H=+284.2KJ/mol����֪�������������ȳ��������ͣ����ʵ�����Խ��Խ�ȶ�����O2��O3Ϊ���ȷ�Ӧ��O2��O3�ȶ�����A��B����
CD�����ø�˹���ɣ�����Ӧ��-�ڵã�3O2��g��=2O3��g������H=+284.2KJ/mol����֪�������������ȳ��������ͣ���O2��O3Ϊ���ȷ�Ӧ����C��ȷ��D����
��ѡC��
���� ���⿼�����Ȼ�ѧ����ʽ����д����˹���ɵ�Ӧ�ã���Ҫ�����������ĸߵ��������ȶ��Ե��жϣ���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
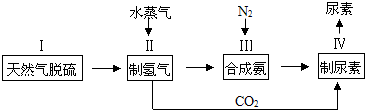
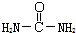 ����д�����ص�ͬ���칹���к������Ӽ��Ļ�ѧʽNH4OCN��
����д�����ص�ͬ���칹���к������Ӽ��Ļ�ѧʽNH4OCN���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�5.6LH2O���еķ�����Ϊ0.25NA | |
| B�� | ���³�ѹ�£�1.06gNa2CO3����Na+������Ϊ0.02NA | |
| C�� | ͨ������£�NA��CO2����ռ�е����Ϊ22.4L | |
| D�� | ���ʵ���Ũ��Ϊ0.5mol/L��MgCl2��Һ�У�����Cl-����ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Һ�к���1mol Na2SO4 | |
| B�� | 500mL��Na2SO4��Һ��SO42-�����ʵ���Ũ��Ϊ0.5 mol/L | |
| C�� | 1L��Һ�к���142gNa2SO4 | |
| D�� | 1molNa2SO4����1LH2O�����Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����29.2kJ���� | B�� | �ų�29.2kJ���� | C�� | �ų�7.3kJ���� | D�� | ����7.3kJ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ӧ4Al��s��+3O2��g��=2Al2O3 ��s�� �ġ�S��0 | |
| B�� | ���ȷ�Ӧ����Ҫ�ڼ��������²��ܽ��� | |
| C�� | ͬ��ͬѹ�£�H2 ��g��+Cl2��g��=2HCl��g���ڹ��պ͵�ȼ�����µġ�H��ͬ | |
| D�� | ��֪����S��s��+O2��g��=SO2��g����H=-a kJ•mol-1�� ��S��g��+O2��g��=SO2��g����H=-b kJ•mol-1����a��b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ҵ�����ȡ�����Խ���ӵ�ˮ����ȡ���� | |
| B�� | �ƾ�����ɱ���������������Ҵ��������� | |
| C�� | ʯ�͵��ѻ�����ҪĿ����������͵������Ͳ��� | |
| D�� | �����ϵ�̼̼����һ�ֽ��ڵ�����˫���Ķ��صļ������Ȳ��ܷ���ȡ����ӦҲ���ܷ����ӳɷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ӱ���ɫ����Һ��Na+��Mg2+��SO42-��Cl- | |
| B�� | ʹ���ȱ��ɫ����Һ��NH4+��Cu2+��ClO-��Cl- | |
| C�� | 0.1mol/LNaHCO3��Һ��K+��AlO2-��Cl-��NO3- | |
| D�� | 0.1mol/L��NH4��2Fe��SO4��2��Һ�У�K+��Cu2+��Cl-��MnO4- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com