

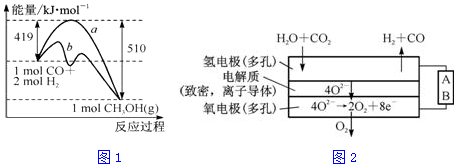
分析 (1)①从原子利用率角度来解答;
②Ⅰ、CO(g)+2H2(g)=CH3OH(g)△H1=-90.1kJ•mol-1
Ⅱ、CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H2=-49.0kJ•mol-1,Ⅰ-Ⅱ得,CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.1 kJ•mol-1,据此进行分析;
③根据②中分析可知,正反应为放热反应,则反应物总能量大于生成物总能量,由于气态物质的能量高于液态物质,故生成液态产物放出的热量更多;
(2)①甲醇燃料电池,电解质为酸,由氢离子向正极移动可知,a为负极,甲醇失去电子发生氧化反应,据此书写电极反应方程式;
②结合电极反应及转移电子计算;
(3)据题意书写离子方程式.
解答 解:(1)①相对反应A,采用反应B制备甲醇的优点是原子利用率为100%,符合原子经济和绿色化学的思想,
故答案为:无副产物生成,原子利用率高;
②Ⅰ、CO(g)+2H2(g)=CH3OH(g)△H1=-90.1kJ•mol-1
Ⅱ、CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H2=-49.0kJ•mol-1,Ⅰ-Ⅱ得,CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.1 kJ•mol-1,
故答案为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.1 kJ•mol-1;
③根据②中分析可知,正反应为放热反应,则反应物总能量大于生成物总能量,由于气态物质的能量高于液态物质,故生成液态产物放出的热量更多,图象中A符合,
故答案为:A;
(2)①根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,负极反应式为 CH3OH-6e-+H2O=CO2+6H+,
故答案为:CH3OH-6e-+H2O=CO2+6H+;
②6.4g甲醇相当于$\frac{6.4g}{32g/mol}$=0.2mol甲醇,据电极反应方程式CH3OH-6e-+H2O=CO2+6H+,1molCH3OH转移6mol电子,故0.2molCH3OH转移1.2mol电子,
故答案为:1.2;
(3)在硝化细菌的作用下将NH4+最终氧化为HNO3,然后加入CH3OH,得到两种无毒气体,故加入CH3OH后发生反应的离子方程式6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O,
故答案为:6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O.
点评 本题考查了热化学方程式的书写、燃料电池电极反应式的书写以及氧化还原反应的书写,本题难度中等.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下5.6L CH4含有的共用电子对数目为NA | |
| B. | 25℃时,pH=1的硫酸溶液中含有H+的数目为0.1NA | |
| C. | 常温下,23g NO2和N2O4混合气体中所含原子总数为1.5NA | |
| D. | 将0.5mol NH4NO3于稀氨水使溶液呈中性,溶液中NH4+数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2NA | |
| B. | 将1 mol Cl2通入水中,HC1O、Cl-、ClO-粒子数之和为2NA | |
| C. | 标准状况下,44.8L NO与22.4 L O2反应后的分子数是2NA | |
| D. | 27g铝中加入1mol/L的NaOH溶液,转移电子数是3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | H-H | C-O | C≡O | O-H |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | x | 463 |
| 离子 | Cu2+ | H+ | Cl- | SO42 - |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
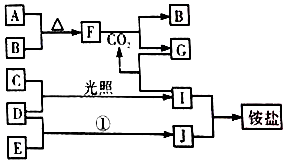 如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应
如图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应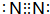 ,F
,F ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如图的键线式表示烃的名称为3-甲基-4-乙基-7-甲基辛烷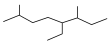 | |
| B. | 符合分子式为C3H8O的醇有三种不同的结构 | |
| C. | 乙烯在一定条件下能发生加成反应、加聚反应,被酸性高锰酸钾溶液氧化,也能在一定条件下被氧气氧化成乙酸 | |
| D. | 溴水能将 甲苯、乙烯、乙醇、四氯化碳、乙酸五种溶液鉴别开来 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com