
分析 分子式为C4H10O并能与金属钠反应放出氢气,则该有机物属于醇,可以可知丁烷中的1个H原子被1个羟基取代产物,书写丁烷的同分异构体,根据等效氢判断丁醇的同分异构体数目.
解答 解:分子式为C4H10O并能与金属钠反应放出氢气,则该有机物属于醇,可以可知丁烷中的1个H原子被羟基取代产物,丁烷有CH3CH2CH2CH3、CH3CH(CH3)CH3,
CH3CH2CH2CH3中有2种H原子,1个H原子被1个羟基取代有2种结构,
CH3CH(CH3)CH3中有2种H原子,1个H原子被1个羟基取代有2种结构,
故符合条件的C4H10O结构共有4种,
故答案为:4.
点评 本题考查同分异构体的书写,题目难度中等,注意掌握书写的方法,利用等效氢进行判断.


科目:高中化学 来源: 题型:选择题
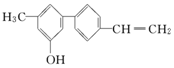
| A. | 完全燃烧时只有二氧化碳和水两种产物 | |
| B. | 由于含有氧元素不是有机物 | |
| C. | 该分子中含有羟基属于醇 | |
| D. | 不能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫酸亚铁溶液中加入双氧水的离子方程式:Fe2++2H2O+4H+=Fe3++4H2O | |
| B. | 粗硅制备的化学方程式:C+SiO2$\frac{\underline{\;高温\;}}{\;}$CO2↑+Si | |
| C. | 石墨作电极电解CuSO4溶液的离子方程式:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| D. | 铁发生吸氧腐蚀时负极上的电极反应式:Fe-3e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素是生物生长发育和新陈代谢所必需的物质 | |
| B. | 按溶解性的不同,维生素可分为脂溶性维生素和水溶性维生素两类 | |
| C. | 缺乏维生素A易患甲状腺肿大 | |
| D. | 缺乏维生素C易患坏血病 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属腐蚀的本质是金属原子失去电子而被氧化 | |
| B. | 钢铁吸氧腐蚀的正极反应是:O2+4e-+2H2O═4OH- | |
| C. | 将地下钢管与直流电源的正极相连,用来保护钢管 | |
| D. | 氢氧燃料电池中,氢气在负极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
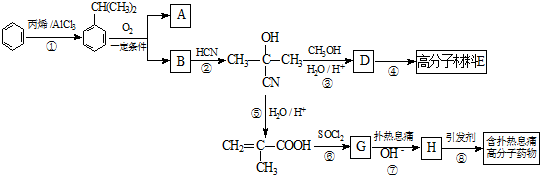
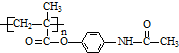 .
.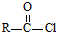
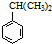 可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式
可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验.请回答下列有关问题:
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验.请回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com