
【题目】用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:
H2O2+I-=H2O+IO-;H2O2+IO-=H2O+O2↑+I-。总反应的化学方程式是________________。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是___________(填字母)。
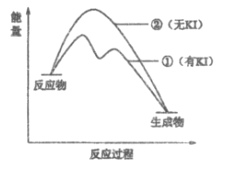
a. 加入KI后改变了反应的路径
b. 加入KI后改变了总反应的能量变化
c. H2O2+I-=H2O+IO-是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
①加CCl4并振荡、静置后还可观察到___________,说明有I2生成。
②气泡明显减少的原因可能是:i. H2O2浓度降低;ii. ________。以下对照实验说明i不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是_____________。
(4)资料4:I-(aq)+I2(aq)![]() I3-(aq) K=640。
I3-(aq) K=640。
为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10mL 0.10mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
微粒 | I- | I2 | I3- |
浓度/(mol·L-1) | 2.5×10-3 | a | 4.0×10-3 |
①a=__________。
②该平衡体系中除了含有I-,I2,I3-外,一定还含有其他含碘微粒,理由是________________。
【答案】2H2O2![]() 2H2O+O2↑ a 下层溶液呈紫红色 在水溶液中I2的浓度降低 A试管中产生气泡明显变少;B试管中产生气泡速率没有明显减小
2H2O+O2↑ a 下层溶液呈紫红色 在水溶液中I2的浓度降低 A试管中产生气泡明显变少;B试管中产生气泡速率没有明显减小 ![]() 2c(I2)+c(I-)+3c(I3-)<0.033mol·L-1
2c(I2)+c(I-)+3c(I3-)<0.033mol·L-1
【解析】
(1)H2O2+I-=H2O+IO-,H2O2+IO-=H2O+O2↑+I-,把两式加和,即可得到总反应的化学方程式。
(2)a. 加入KI后,一步反应分为两步进行,也就是改变了反应的路径,a正确;
b. 加入KI后,反应物和生成物的能量都没有改变,b不正确;
c. 由图中可知,H2O2+I-=H2O+IO-是吸热反应,c不正确。
(3)①加CCl4并振荡、静置后还可观察到下层溶液呈紫红色,说明有I2生成。
②气泡明显减少的原因可能是:i. H2O2浓度降低;ii. 在水溶液中I2的浓度降低。以下对照实验说明i不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是H2O2溶液的浓度相同,但产生气泡的速率差异很大。
(4)① ![]() ,由此可求出a。
,由此可求出a。
②该平衡体系中除了含有I-,I2,I3-外,一定还含有其他含碘微粒,理由是原来溶液中c(I-)=![]() ,求出I-,I2,I3-中所含I的浓度和,二者比较便可得到结论。
,求出I-,I2,I3-中所含I的浓度和,二者比较便可得到结论。
(1)H2O2+I-=H2O+IO-,H2O2+IO-=H2O+O2↑+I-,把两式加和,即可得到总反应的化学方程式为2H2O2![]() 2H2O+O2↑。答案为:2H2O2
2H2O+O2↑。答案为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(2)a. 加入KI后,一步反应分为两步进行,也就是改变了反应的路径,a正确;
b. 加入KI后,反应物和生成物的能量都没有改变,b不正确;
c. 由图中可知,H2O2+I-=H2O+IO-的反应物总能量小于生成物总能量,所以该反应是吸热反应,c不正确。答案为:a;
(3)①加CCl4并振荡、静置后还可观察到下层溶液呈紫红色,说明有I2生成。答案为:下层溶液呈紫红色;
②气泡明显减少的原因可能是:i. H2O2浓度降低;ii. 在水溶液中I2的浓度降低。以下对照实验说明i不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是H2O2溶液的浓度相同,但产生气泡的速率差异很大。答案为:在水溶液中I2的浓度降低;A试管中产生气泡明显变少,B试管中产生气泡速率没有明显减小;
(4)① ![]() ,由此可求出a=2.5×10-3mol/L。答案为:2.5×10-3;
,由此可求出a=2.5×10-3mol/L。答案为:2.5×10-3;
②该平衡体系中除了含有I-,I2,I3-外,一定还含有其他含碘微粒,理由是原来溶液中,c(I-)=![]() ;现在溶液中,I-,I2,I3-中所含I的浓度和为2c(I2)+c(I-)+3c(I3-)=2×2.5×10-3+2.5×10-3+3×4.0×10-3=0.0195<0.033,I不守恒,说明产物中还有含碘微粒。答案为:2c(I2)+c(I-)+3c(I3-)<0.033mol·L-1。
;现在溶液中,I-,I2,I3-中所含I的浓度和为2c(I2)+c(I-)+3c(I3-)=2×2.5×10-3+2.5×10-3+3×4.0×10-3=0.0195<0.033,I不守恒,说明产物中还有含碘微粒。答案为:2c(I2)+c(I-)+3c(I3-)<0.033mol·L-1。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列电离方程式书写不正确的是
A.HNO3=H+ + NO![]() B.Al2(SO4)3=2Al3+ + 3SO
B.Al2(SO4)3=2Al3+ + 3SO![]()
C.Ba(OH)2=Ba2+ + 2OH-D.NaHCO3=Na+ + H+ + CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C9H18O2的有机物A,在硫酸存在下与水反应生成B、C两种物质,C经一系列氧化最终可转化为B的同类物质,又知等质量的B、C的蒸气在同温同压下所占体积相同,则A的结构共有( )
A. 8种
B. 12种
C. 16种
D. 18种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将锌、铜通过导线相连,置于稀硫酸中:
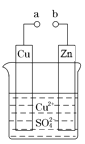
(1)锌片上的现象是______,电极反应为________。
(2)铜片上的现象是_________,电极反应为_________。
(3)电子由________经导线流向_____________。
(4)若反应过程中有0.2 mol电子发生转移,则生成的氢气在标准状况下的体积为 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol仅含C、H、O三种元素的有机物A在稀硫酸中水解生成1molB和1molC, B分子中N(C)∶N(H)=4∶5,135<Mr(B)<140;C与B分子中碳原子数相同,且Mr(B)=Mr(C)+2
(1)C的分子式为_____________________,
(2)B的分子具有高度对称性,苯环上的一氯取代物只有一种。B能与金属Na反应但不能与NaOH反应。写出B的结构简式_________________________;
(3)C有多种同分异构体,其中属于芳香族的酯类的同分异构体有_____________种;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(化合物L)是人们熟知的解热镇痛药物。一种长效、缓释阿司匹林(化合物P)的合成路线如图所示:

已知:①HC![]() CH+RCOOH
CH+RCOOH![]() RCOOCH=CH2
RCOOCH=CH2
②RCOOR’+R”OH![]() RCOOR”+R’OH
RCOOR”+R’OH
(1)B中的官能团是__。
(2)C的结构简式是__。
(3)D→E的反应类型是__。
(4)E→G的化学方程式是__。
(5)已知:H是芳香族化合物。在一定条件下2B→K+H2O,K的核磁共振氢谱只有一组峰。J→L的化学方程式是__。
(6)L在体内可较快转化为具有药效的J,而P与L相比,在体内能缓慢持续释放J。
①血液中J浓度过高能使人中毒,可静脉滴注NaHCO3溶液解毒。请用化学方程式解释NaHCO3的作用:__。
②下列说法正确的__(填字母)。
a.P中的酯基在体内可缓慢水解,逐渐释放出J
b.P在体内的水解产物中没有高分子化合物
c.将小分子药物引入到高分子中可以实现药物的缓释功能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A.侯氏制碱法:NH3+CO2+H2O=![]() +
+ ![]()
B.小苏打溶液与稀硫酸混合:![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
C.向Ba(OH)2溶液中加少量NaHCO3: ![]() +Ba2++OH-=BaCO3↓+H2O
+Ba2++OH-=BaCO3↓+H2O
D.硫酸亚铁溶液与过氧化氢溶液混合:Fe2++2H2O2+4H+=Fe3++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基于临床研究,抗疟疾药物磷酸氯喹被证实在治疗新冠肺炎过程中具有疗效。4,7-二氯喹啉是合成磷酸氯喹的一种中间体,其结构简式如图所示。下列有关该物质的说法不正确的是
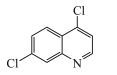
A.属于芳香族化合物B.分子中所有原子在同一平面上
C.分子式为C9H6NCl2D.可发生取代、加成、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是( )
A.4.6gNa完全转化成Na2O和Na2O2的混合物,生成物中阴离子总数为0.1NA
B.标准状况下,22.4L丙烷所含共用电子对数为8NA
C.标准状况下,2.24LCl2溶于水,转移的电子数目为0.1NA
D.常温下,1L0.1mol·L-1NH4NO3溶液中含有的NH4+数是0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com