
 )×22.4L;
)×22.4L; )]mol.
)]mol. )]mol,根据铝元素守恒可知,溶液中偏铝酸钠为(1-a)mol.
)]mol,根据铝元素守恒可知,溶液中偏铝酸钠为(1-a)mol. ×100%=40%,故①正确;
×100%=40%,故①正确; =(1-
=(1- )mol,反应中放出NO的体积在标准状况下为(1-
)mol,反应中放出NO的体积在标准状况下为(1-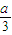 )×22.4L,故②正确;
)×22.4L,故②正确; )]mol,根据铝元素守恒可知,溶液中偏铝酸钠为(1-a)mol,所以氢氧化钠的可以表示为[b-(1-
)]mol,根据铝元素守恒可知,溶液中偏铝酸钠为(1-a)mol,所以氢氧化钠的可以表示为[b-(1-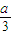 )]mol+(1-a)mol,故④错误.
)]mol+(1-a)mol,故④错误.

 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| (x-0.04y) |
| 0.06 |
| 1 |
| 2 |
| (x-0.04y) |
| 0.06 |
| ||
| ||
| C(CH3OH)C(H2O) |
| C(CO2)C3(H2) |
| C(CH3OH)C(H2O) |
| C(CO2)C3(H2) |
| 容 器 | 甲 | 乙 |
| 反应物 投入量 |
1molCO2 3molH2 |
a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| a |
| 3 |
| a |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2009?肇庆二模)某校科技活动小组用镁粉、盐酸、醋酸及设计的右图装置(夹持固定装置已略去),对两种酸分别与镁反应的速率以及是否存在电离平衡进行探究.
(2009?肇庆二模)某校科技活动小组用镁粉、盐酸、醋酸及设计的右图装置(夹持固定装置已略去),对两种酸分别与镁反应的速率以及是否存在电离平衡进行探究.| A烧瓶中 | B烧瓶中 | 20℃、101kPa 50mL量筒内气体读数 |
反应时间 | |
| A瓶 | B瓶 | |||
| 40mL0.1mol/L 醋酸溶液 |
40mL0.1mol/L 盐酸溶液 |
5mL | t(a1)=155s | t(b1)=7s |
| 10mL | t(a2)=310s | t(b2)=16s | ||
| 15mL | t(a3)=465s | t(b3)=30s | ||
| 20mL | t(a4)=565s | t(b4)=64s | ||
| … | … | … | ||
| 44.8mL | t(an)=865s | t(bn)=464s | ||
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
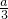 )×22.4L;
)×22.4L;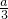 )]mol.
)]mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com