
| | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 5.2 |
| 完全沉淀时的pH | 3.7 | 9.6 | 6.4 |


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源:不详 题型:单选题
| A.绝对不溶解的物质是不存在的 |
| B.不溶于水的物质溶解度为0 |
| C.物质的溶解性为难溶,则该物质不溶于水 |
| D.某离子被沉淀完全是指该离子在溶液中的浓度为0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是( )
CuS(s)+Mn2+(aq)。下列有关该反应的推理不正确的是( )| A.该反应达到平衡时:c(Cu2+)=c(Mn2+) |
| B.CuS的溶解度比MnS的溶解度小 |
| C.往平衡体系中加入少量Cu(NO3)2(s)后,c(Mn2+)变大 |
D.该反应平衡常数表达式:K=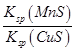 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.白色沉淀为ZnS,黑色沉淀为CuS |
| B.利用该原理可实现一种沉淀转化为更难溶的沉淀 |
| C.上述现象说明ZnS的Ksp小于CuS的Ksp |
| D.该过程破坏了ZnS的溶解平衡 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.AgCl>AgI>Ag2CrO4 | B.AgCl>Ag2CrO4>AgI |
| C.Ag2CrO4>AgCl>AgI | D.Ag2CrO4>AgI>AgCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Pb2+(aq)+2I-(aq),若再加入少量PbI2固体,下列说法不正确的是
Pb2+(aq)+2I-(aq),若再加入少量PbI2固体,下列说法不正确的是 | A.溶液中Pb2+和I-浓度都增大 | B.溶度积常数Ksp不变 |
| C.沉淀溶解平衡不移动 | D.溶液中Pb2+和I-浓度不变 |
查看答案和解析>>
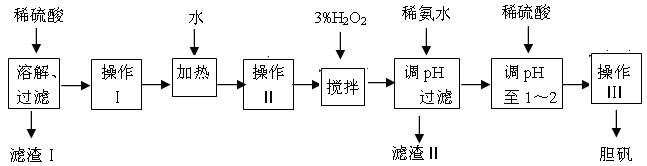
科目:高中化学 来源:不详 题型:填空题
| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| KSP | 8.0×10-16 | 4.0×10-38 | 3.0×10-17 | 2.2×10-20 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 相关化合物 | AgX | AgY | AgZ |
| pKsp | a | b | c |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.AgCl=AgI=Ag2S | B.AgCl<AgI<Ag2S |
| C.AgCl>AgI>Ag2S | D.AgI>AgCl>Ag2S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com