
”¾ĢāÄæ”æ¼ŗÖŖÓŠ»śĪļAŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬×Ŗ»Æ¹ŲĻµČēĻĀĶ¼:
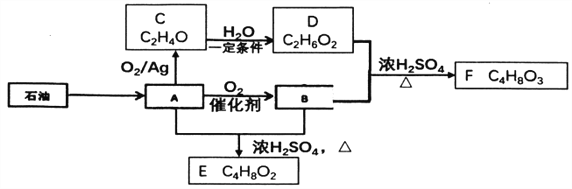
ŅŃÖŖ:Ķ¬Ņ»Ģ¼Ō×ÓÉĻĮ¬½Ó2øö»ņ2øöŅŌÉĻ-OHŹĒ²»ĪČ¶Ø½į¹¹£¬EÄÜ·¢ÉśĖ®½ā·“Ó¦
Ēė»Ų“š:
£Ø1£©AÖŠ¹ŁÄÜĶÅĆū³Ę________”£
£Ø2£©ÓŠ»śĪļCµÄ½į¹¹¼ņŹ½________”£
£Ø3£©B+D-FµÄ»Æѧ·½³ĢŹ½ŹĒ________”£
£Ø4£©ŅŃÖŖ![]() ÄÜ°“ĻĀĶ¼·½Ź½½ųŠŠĮŃ½ā:
ÄÜ°“ĻĀĶ¼·½Ź½½ųŠŠĮŃ½ā:
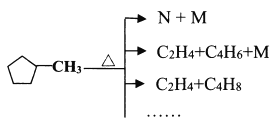
ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ________”£
A.æÉÓĆäåĖ®Ēų·Ö![]() ŗĶN
ŗĶN
B.EŗĶ![]() ¶¼æÉŅŌŹ¹ĖįŠŌKMnO4ĶŹÉ«
¶¼æÉŅŌŹ¹ĖįŠŌKMnO4ĶŹÉ«
C.µČÖŹĮæµÄAŗĶ![]() ĶźČ«Č¼ÉÕŹ±µÄŗÄŃõĮæĻąĶ¬
ĶźČ«Č¼ÉÕŹ±µÄŗÄŃõĮæĻąĶ¬
D.N(ĪåŌŖ»·)æÉÄܵĽį¹¹ÓŠ3ÖÖ
”¾“š°ø”æ Ģ¼Ģ¼Ė«¼ü ![]() HOCH2”ŖCH2OH+CH3COOH
HOCH2”ŖCH2OH+CH3COOH![]() CH3COOCH2CH2OH+H2O BD
CH3COOCH2CH2OH+H2O BD
”¾½āĪö”æ±¾Ģāæ¼²éÓŠ»śĪļµÄĶʶĻ£¬AŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬ĒŅAŹĒÓÉŹÆÓĶµĆµ½£¬ĒŅAÄÜÉś³ÉC£¬Ņņ“ĖAĪŖŅŅĻ©£¬¼“½į¹¹¼ņŹ½ĪŖCH2=CH2£¬E·Ö×ÓŹ½ĪŖC4H8O2£¬ĒŅEŹĒÓÉAŗĶBŌŚÅØĮņĖįµÄ×÷ÓĆĻĀ£¬Éś³É£¬¼“EĪŖõ„£¬½į¹¹¼ņŹ½ĪŖCH3COOCH2CH3£¬BĪŖCH3COOH£¬DŗĶEŌŚÅØĮņĖįĢõ¼žĻĀ·“Ӧɜ³ÉF£¬ŅŌ¼°FµÄ½į¹¹¼ņŹ½£¬ĶĘ³öFĪŖõ„£¬ŌņDĪŖCH3CH2OH£¬ŌņCµÄ½į¹¹¼ņŹ½ĪŖ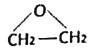 £¬£Ø1£©AÖŠŗ¬ÓŠµÄ¹ŁÄÜĶÅŹĒĢ¼Ģ¼Ė«¼ü£»£Ø2£©øł¾ŻÉĻŹö·ÖĪö£¬CµÄ½į¹¹¼ņŹ½ĪŖ
£¬£Ø1£©AÖŠŗ¬ÓŠµÄ¹ŁÄÜĶÅŹĒĢ¼Ģ¼Ė«¼ü£»£Ø2£©øł¾ŻÉĻŹö·ÖĪö£¬CµÄ½į¹¹¼ņŹ½ĪŖ £»£Ø3£©øł¾ŻFµÄ·Ö×ÓŹ½£¬BŗĶD·“Ó¦µÄ·½³ĢŹ½ĪŖ HOCH2”ŖCH2OH+CH3COOH
£»£Ø3£©øł¾ŻFµÄ·Ö×ÓŹ½£¬BŗĶD·“Ó¦µÄ·½³ĢŹ½ĪŖ HOCH2”ŖCH2OH+CH3COOH![]() CH3COOCH2CH2OH+H2O£»£Ø4£©
CH3COOCH2CH2OH+H2O£»£Ø4£©![]() Éś³ÉC2H4”¢C4H6”¢M£¬øł¾ŻŌŖĖŲŹŲŗćŗĶŌ×ÓŹŲŗć£¬ĶĘ³öMĪŖH2£¬
Éś³ÉC2H4”¢C4H6”¢M£¬øł¾ŻŌŖĖŲŹŲŗćŗĶŌ×ÓŹŲŗć£¬ĶĘ³öMĪŖH2£¬![]() Éś³ÉNŗĶM£¬ĶĘ³öNµÄ·Ö×ÓŹ½ĪŖC6H10£¬¼“NÖŠŗ¬ÓŠĢ¼Ģ¼Ė«¼ü£¬A”¢
Éś³ÉNŗĶM£¬ĶĘ³öNµÄ·Ö×ÓŹ½ĪŖC6H10£¬¼“NÖŠŗ¬ÓŠĢ¼Ģ¼Ė«¼ü£¬A”¢![]() ²»ŗ¬Ģ¼Ģ¼Ė«¼ü£¬²»ÄÜŹ¹äåĖ®ĶŹÉ«£¬NÖŠŗ¬ÓŠĢ¼Ģ¼Ė«¼ü£¬ÄÜŹ¹äåĖ®ĶŹÉ«£¬Ņņ“ĖæÉŅŌÓĆäåĖ®¼ų±š
²»ŗ¬Ģ¼Ģ¼Ė«¼ü£¬²»ÄÜŹ¹äåĖ®ĶŹÉ«£¬NÖŠŗ¬ÓŠĢ¼Ģ¼Ė«¼ü£¬ÄÜŹ¹äåĖ®ĶŹÉ«£¬Ņņ“ĖæÉŅŌÓĆäåĖ®¼ų±š![]() ŗĶN£¬¹ŹAĖµ·ØÕżČ·£»B”¢EŗĶ
ŗĶN£¬¹ŹAĖµ·ØÕżČ·£»B”¢EŗĶ![]() ¶¼²»ŗ¬Ģ¼Ģ¼Ė«¼ü£¬Ņņ“Ė²»ÄÜŹ¹ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«£¬¹ŹBĖµ·Ø“ķĪó£»C”¢AµÄ·Ö×ÓŹ½ĪŖC2H4£¬
¶¼²»ŗ¬Ģ¼Ģ¼Ė«¼ü£¬Ņņ“Ė²»ÄÜŹ¹ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«£¬¹ŹBĖµ·Ø“ķĪó£»C”¢AµÄ·Ö×ÓŹ½ĪŖC2H4£¬![]() µÄ·Ö×ÓŹ½ĪŖC6H12£¬µČÖŹĮæŹ±£¬C2H4”śCH2£¬C6H12”śCH2£¬Ņņ“ĖµČÖŹĮæŹ±£¬ĻūŗĵÄŃõĘųµÄĮæĻąĶ¬£¬¹ŹCĖµ·ØÕżČ·£»D”¢
µÄ·Ö×ÓŹ½ĪŖC6H12£¬µČÖŹĮæŹ±£¬C2H4”śCH2£¬C6H12”śCH2£¬Ņņ“ĖµČÖŹĮæŹ±£¬ĻūŗĵÄŃõĘųµÄĮæĻąĶ¬£¬¹ŹCĖµ·ØÕżČ·£»D”¢![]() Éś³ÉNŗĶM£¬MĪŖĒāĘų£¬Ņņ“Ė“Ė·“Ӧɜ³ÉĢ¼Ģ¼Ė«¼ü£¬¼“NµÄ½į¹¹¼ņŹ½æÉÄÜĪŖ
Éś³ÉNŗĶM£¬MĪŖĒāĘų£¬Ņņ“Ė“Ė·“Ӧɜ³ÉĢ¼Ģ¼Ė«¼ü£¬¼“NµÄ½į¹¹¼ņŹ½æÉÄÜĪŖ ”¢
Ӣ![]() Ӣ
Ӣ![]() Ӣ
”¢![]() ¹²ÓŠ4ÖÖ£¬¹ŹDĖµ·Ø“ķĪó”£
¹²ÓŠ4ÖÖ£¬¹ŹDĖµ·Ø“ķĪó”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬¶žŌŖČõĖį H2Y ČÜŅŗÖŠµĪ¼Ó KOH ČÜŅŗ£¬ĖłµĆ»ģŗĻČÜŅŗµÄ pH ÓėĄė×ÓÅØ¶Č±ä»ÆµÄ¹ŲĻµČēĶ¼ĖłŹ¾£¬ĻĀĮŠÓŠ¹ŲĖµ·Ø“ķĪóµÄŹĒ
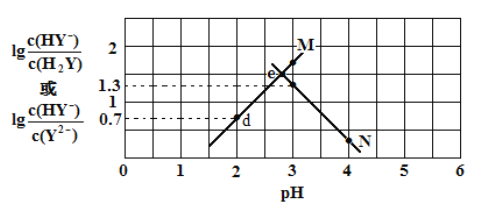
A. ĒśĻß M ±ķŹ¾ pHÓė![]() µÄ±ä»Æ¹ŲĻµ
µÄ±ä»Æ¹ŲĻµ
B. Ka2(H2Y)=10-2.7
C. d µćČÜŅŗÖŠ: c(H+)£c(OH -)£½2c(Y2-)£« c(HY-)£c(K+)
D. ½»µć e µÄČÜŅŗÖŠ: c(H2Y) = c(Y2-) > c(HY-)> c(H+)> c(OH -)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøł¾ŻČēĶ¼µÄÄÜĮæĶ¼£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
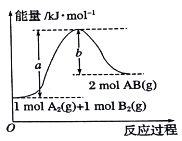
A. A2(g)+B2(g)=2AB(g)ŹĒŅ»øö·ÅČČ·“Ó¦
B. 2molABµÄ×ÜÄÜĮæ“óÓŚ1molA2ŗĶlmolB2µÄÄÜĮæÖ®ŗĶ
C. 1molA2(g)ŗĶ1molB2(g)µÄÄÜĮæÖ®ŗĶĪŖakJ
D. 2AB(g)=A2(l)+B2(l)”÷H<(b-a)kJ/mo1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ25”ꏱ£¬½«ÅØ¶Č¾łĪŖ0.1 mol/L”¢Ģå»ż·Ö±šĪŖVaŗĶVbµÄHAČÜŅŗÓėBOHČÜŅŗ°“²»Ķ¬Ģå»ż±Č»ģŗĻ£¬±£³ÖVa+Vb=100 mL£¬Va”¢VbÓė»ģŗĻŅŗµÄpHµÄ¹ŲĻµČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
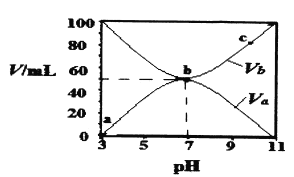
A. Ka(HA)=10-6mol”¤L-l
B. bµćŹ±£¬c(B+)=c£ØA-£©=c(H+)=c(OH-)
C. b”śc¹ż³ĢÖŠ£¬![]() ĖęĪĀ¶ČÉżø߶ųŌö“ó
ĖęĪĀ¶ČÉżø߶ųŌö“ó
D. a”śc¹ż³ĢÖŠĖ®µÄµēĄė³Ģ¶ČŹ¼ÖÕŌö“ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŌĻĀ·“Ó¦ŹōÓŚĪüČČ·“Ó¦µÄŹĒ£Ø £©
A.ÉśŹÆ»Ņ¼ÓĖ®ÖĘŹģŹÆ»Ņ
B.»ÆŹÆČ¼ĮĻµÄČ¼ÉÕ
C.ĒāŃõ»ÆÄĘČÜŅŗÖŠµĪ¼ÓĻ”ŃĪĖį
D.¶žŃõ»ÆĢ¼ÓėøßĪĀµÄĢæ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»ÆŗĻĪļXÓÉĮ½ÖÖŌŖĖŲ×é³É£¬ĪŖĢ½¾æĘä×é³ÉŗĶŠŌÖŹ£¬Éč¼Ę²¢Ķź³ÉČēĻĀŹµŃé:
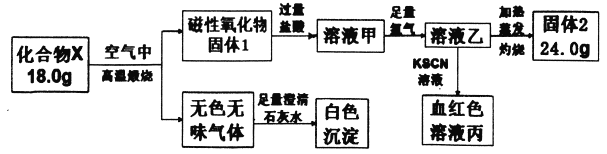
Ēė»Ų“š£ŗ
£Ø1£©XµÄ»ÆѧŹ½ŹĒ________”£
£Ø2£©ČÜŅŗ¼×Óė×ćĮæĀČĘų·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ____________”£
£Ø3£©¼ÓČČĢõ¼žĻĀ°±Ęų±»¹ĢĢå2Ńõ»Æ³ÉŅ»ÖÖĘųĢåµ„ÖŹ£¬Š“³öøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½_________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æX”¢Y”¢Z”¢P”¢QĪŖĪåÖÖ¶ĢÖÜĘŚŌŖĖŲ£¬ĘäŌ×Ó°ė¾¶ŗĶ×īĶā²ćµē×ÓŹżÖ®¼äµÄ¹ŲĻµČēĻĀĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
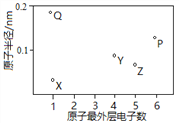
A. XÓėQŠĪ³ÉµÄ»ÆŗĻĪļŹĒĄė×Ó»ÆŗĻĪļ
B. XÓėZµÄŌ×Ó¾łŗ¬ÓŠ1øöĪ“³É¶Ōµē×Ó
C. YÓėPŠĪ³ÉµÄ»ÆŗĻĪļYP2µÄ·Ö×Óæռ乹ŠĶŹĒÖ±ĻߊĪ
D. Qµ„ÖŹŗ¬ÓŠ½šŹō¼ü£¬ÓŠ×ŌÓÉŅĘ¶ÆµÄµē×Ó£¬Ņņ“ĖæÉŅŌµ¼µē
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ·“Ó¦A£Øg£©+3B£Øg£©ØT2C£Øg£©+D£Øg£©ŌŚÄ³¶ĪŹ±¼äÄŚŅŌAµÄÅØ¶Č±ä»Æ±ķŹ¾µÄ»Æѧ·“Ó¦ĖŁĀŹĪŖ1mol/£ØLmin£©£¬Ōņ“Ė¶ĪŹ±¼äÄŚŅŌCµÄÅØ¶Č±ä»Æ±ķŹ¾µÄ»Æѧ·“Ó¦ĖŁĀŹĪŖ£Ø £©
A.0.5 mol/£ØLmin£©
B.1 mol/£ØLmin£©
C.2 mol/£ØLmin£©
D.3 mol/£ØLmin£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻąĶ¬ĪĀ¶ČĻĀ£¬Ģå»ż¾łĪŖ0.25 LµÄĮ½øöĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£ŗX2(g)£«3Y2(g) ![]() 2XY3(g)””¦¤H£½£92.6 kJ”¤mol£1ŹµŃé²āµĆ·“Ó¦ŌŚĘšŹ¼”¢“ļµ½Ę½ŗāŹ±µÄÓŠ¹ŲŹż¾ŻČēĻĀ±ķĖłŹ¾£ŗ
2XY3(g)””¦¤H£½£92.6 kJ”¤mol£1ŹµŃé²āµĆ·“Ó¦ŌŚĘšŹ¼”¢“ļµ½Ę½ŗāŹ±µÄÓŠ¹ŲŹż¾ŻČēĻĀ±ķĖłŹ¾£ŗ
ĘšŹ¼Ź±ø÷ĪļÖŹĪļÖŹµÄĮæ/mol | “ļĘ½ŗāŹ±ĢåĻµÄÜĮæµÄ±ä»Æ | |||
ČŻĘ÷ | X2 | Y2 | XY3 | |
ČŻĘ÷¢ŁŗćĪĀŗćČŻ | 1 | 3 | 0 | ·ÅČČ 23.15 kJ |
ČŻĘ÷¢ŚŗćĪĀŗćŃ¹ | 1 | 3 | 0 | Q(Q£¾0) |
ĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø £©
A. ČŻĘ÷¢Ł”¢¢ŚÖŠ·“Ó¦ĪļX2µÄ×Ŗ»ÆĀŹĻąĶ¬
B. “ļĘ½ŗāŹ±£¬Į½øöČŻĘ÷ÖŠXY3µÄĪļÖŹµÄĮæÅØ¶Č¾łĪŖ2 mol”¤L£1
C. ČŻĘ÷¢Ł”¢¢Ś“ļµ½Ę½ŗāŹ±¼äĻąĶ¬
D. ČŻĘ÷¢Ś£¬ Q“óÓŚ23£®15 kJ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com