
已知0.1mol/L H2SO4在水中的第一步电离是完全的,第二步电离并不完全。常温下有0.1mol/L的以下几种溶液的电离度(即已经电离的分子数占原来分子总数的百分数)如下表,回答下列问题:
①H2SO4溶液中的HSO4– | ②NaHSO4溶液中的HSO4– | ③CH3COOH | ④HCl溶液 |
10% | 29% | 1.33% | 100% |
(1)写出H2SO4在水中的电离方程式 。
(2)常温下,题设条件下的①溶液中c(H+)= 。
(3)常温下,pH相同的上述几种溶液,其物质的量浓度由大到小的顺序是(填序号) 。
(4)若将10mL题设条件下的NaHSO4溶液与0.1mol/LNaOH溶液等体积混合,则混合后溶液中离子浓度由大到小顺序为 。
(5)根据题设条件计算CH3COOH的电离常数Ka= 。若常温下,将b mol·L–1的CH3COONa液与0.01 mol·L–1的盐酸等体积混合,反应达平衡时,测得溶液的pH=7,用含b的代数式表示CH3COOH的电离常数Ka= 。
(1)H2SO4=HSO4–+H+ HSO4– H++ SO42– (2分) (2)0.11 mol·L–1 (2分)
H++ SO42– (2分) (2)0.11 mol·L–1 (2分)
(3)③②④①或③>②>④>① (2分)
(4)c(Na+)>c(SO42–)>c(OH–)>c(HSO4–)>c(H+) (2分)
(5)1.77×10–5或1.8×10–5 (2分) 或(b-0.01)×10-5 (2分)
或(b-0.01)×10-5 (2分)
【解析】
试题分析:(1)已知0.1mol/L H2SO4在水中的第一步电离是完全的,第二步电离并不完全,所以硫酸在水中的电离方程式为H2SO4=HSO4–+H+ HSO4– H++ SO42–。
H++ SO42–。
(2)H2SO4 = HSO4– + H+
0.1mol/L 0.1mol/L 0.1mol/L
HSO4–  H++ SO42–
H++ SO42–
0.1mol/L×10% 0.1mol/L×10%
所以溶液中氢离子浓度=0.1mol/L+0.1mol/L×10%=0.11mol/L
(3)硫酸是二元酸,第一步完全电离,第二步部分电离。盐酸是一元酸,完全电离。硫酸氢钠中HSO4-的电离程度强于醋酸的电离程度,所以常温下,pH相同的上述几种溶液,其物质的量浓度由大到小的顺序是③>②>④>①。
(4)将10mL题设条件下的NaHSO4溶液与0.1mol/LNaOH溶液等体积混合,二者恰好反应生成硫酸钠,但由于SO42-水解SO42-+H2O HSO4-+OH-,因此溶液显碱性。又因为水还电离出OH-,所以溶液中离子浓度大小顺序是c(Na+)>c(SO42–)>c(OH–)>c(HSO4–)>c(H+)。
HSO4-+OH-,因此溶液显碱性。又因为水还电离出OH-,所以溶液中离子浓度大小顺序是c(Na+)>c(SO42–)>c(OH–)>c(HSO4–)>c(H+)。
(5)醋酸的电离度是1.33%,则
CH3COOH CH3COO- + H+
CH3COO- + H+
起始浓度(mol/L) 0.1 0 0
转化浓度(mol/L) 0.1×1.33% 0.1×1.33% 0.1×1.33%
平衡浓度(mol/L)0.1-0.00133 0.00133 0.00133
所以该温度下醋酸的电离常数=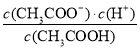 =
=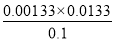 =1.77×10–5
=1.77×10–5
反应达平衡时,测得溶液的pH=7,则根据电荷守恒可知c(CH3COO-)+c(Cl-)+c(OH–)=c(Na+)+c(H+),因此c(OH–)=c(H+)=10-7mol/L、c(CH3COO-)+c(Cl-)=c(Na+)=0.5bmol/L,所以c(CH3COO-)=c(Na+)-c(Cl-)=0.5bmol/L-0.005mol/L。根据物料守恒可知溶液醋酸的浓度是0.5bmol/L-(0.5bmol/L-0.005mol/L)=0.005mol/L,所以该温度下醋酸的电离常数=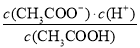 =
=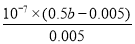 =(b-0.01)×10-5
=(b-0.01)×10-5
考点:考查弱电解质的电离、氢离子浓度与电离平衡常数计算以及溶液中离子浓度大小比较


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源:2015届湖北省荆门市高二上学期期末质量检测化学试卷(解析版) 题型:选择题
下列表述中正确的是
A.任何能使熵值增大的过程都能自发进行
B.△H<0,△S>0的化学反应一定能自发进行
C.已知热化学方程式2SO2(g)+O2(g)  2SO3(g) △H=-QkJ·mol-1(Q>0),则将2mol SO2(g) 和1mol O2(g) 置于一密闭容器中充分反应后放出Q kJ的热量
2SO3(g) △H=-QkJ·mol-1(Q>0),则将2mol SO2(g) 和1mol O2(g) 置于一密闭容器中充分反应后放出Q kJ的热量
D.稀溶液中1mol NaOH分别和1mol CH3COOH、1molHNO3反应,两者放出的热量一样多
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆州市部分县市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列表述不正确的是
A.对于一个确定的反应来说,平衡常数的数值越大,反应限度越大
B.铝热反应会放出大量的热,因此常温下就能顺利发生
C.碳酸铵[(NH4)2CO3]在室温下就能自发地分解产生氨气,碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大
D.对于化学反应COCl2(g)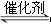 CO(g)+Cl2(g) ΔH<0当反应达平衡时,恒温恒压条件下通入Ar,能提高COCl2的转化率
CO(g)+Cl2(g) ΔH<0当反应达平衡时,恒温恒压条件下通入Ar,能提高COCl2的转化率
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高二上学期期末考试化学试卷(解析版) 题型:选择题
向四个体积相同的密闭容器中分别充人一定量的SO2和O2,开始反应是,按正反应速率由大到小的顺序排列正确的是
甲:在 500℃时,SO2和O2各 10 mol 反应
乙:在500℃时,用V2O5作催化剂,SO2和O2各10 mol反应
丙:在450℃时,8 mol SO2和5 mol O2反应
丁:在500℃时,8 mol SO2和5 mol O2反应
A.乙、甲、丁、丙 B .乙、申、丙、丁
C.甲、乙、丙、丁 D .丁、丙、乙、甲
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列过程需要通电才能进行的是
①电离 ②电解 ③电镀 ④电泳 ⑤电化学腐蚀
A.① ② ③ B.②④⑤ C.②③④ D.全部
查看答案和解析>>
科目:高中化学 来源:2015届湖北省三校高二上学期期末联考化学试卷(解析版) 题型:选择题
取五等份NO2 ,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g) N2O4(g) ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
N2O4(g) ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
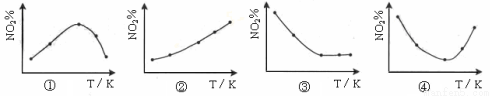
A.②④ B.② C.①② D.③④
查看答案和解析>>
科目:高中化学 来源:2015届湖北省三校高二上学期期末联考化学试卷(解析版) 题型:选择题
下列叙述中正确的有
①燃烧热是指1 mol可燃物完全燃烧生成氧化物时所释放的能量
②某反应的△H=+100kJ/mol,可知该反应的正反应活化能比逆反应活化能大100kJ/mol
③碳酸铵在室温条件下能自发分解产生氨气,是因为生成了气体,体系的熵增大
④强电解质水溶液的导电能力一定比弱电解质水溶液的导电能力强
⑤Mg比Al活泼,在Mg和Al形成的原电池中,Mg必定做负极
⑥轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阳极的阴极保护法进行保护
A.3 B.4 C.5 D.6
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高二下学期期中考试化学试卷(解析版) 题型:填空题
一元酯A在酸性条件下水解得到一元饱和羧酸M与醇N(分子式为C5H12O),且醇N在一定条件下可氧化为M.则此酯A最多有几种结构
A.4种 B.3种 C.16种 D.32种
查看答案和解析>>
科目:高中化学 来源:2015届浙江省慈溪市高二上学期期末测试化学试卷(解析版) 题型:选择题
分类是科学研究的重要方法,下列物质分类不正确的是
A.化合物:冰水混合物,烧碱,小苏打
B.非电解质:乙醇,铜,葡萄糖
C.分子晶体:干冰,硫磺,冰醋酸
D.混合物:铝热剂,纯净矿泉水,分析纯盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com