
1)在潜水艇中可用过氧化钠作为供氧剂。请选择适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。

①A是制取CO2的装置。写出A中发生反应的化学方程式:____________________________________________________。
②B中盛有饱和NaHCO3溶液,其作用是____________________________________________________。
③写出过氧化钠与二氧化碳反应的化学方程式____________________________________________________
____________________________________________________。
④D中盛放的试剂是________,其目的是____________________________________________________。
⑤试管F中收集满气体后,下一步实验操作是____________________________________________________
____________________________________________________。
(2)①某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断合理吗?________,简要说明理由:
____________________________________________________。
②该同学无法断定反应中是否有氧气生成,拟使用如图所示装置进行实验(图中铁架台等装置已略去)。
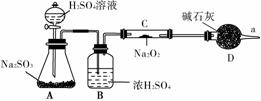
装置B的作用是____________________________________________________,
D的作用是____________________________________________________。
③为确认反应产物,该同学设计了以下实验步骤,你认为合理的操作顺序是________(选填序号)。
A.用带火星的细木条靠近干燥管口a,观察细木条是否复燃
B.将C装置中反应后的固体物质溶于适量水配成溶液
C.在配成的溶液中加入用硝酸酸化的硝酸钡溶液,观察是否有沉淀生成
D.在配成的溶液中先加入盐酸,再加入氯化钡溶液,观察是否有气泡或沉淀生成
答案 (1)①CaCO3+2HCl===CaCl2+CO2↑+H2O
②除去CO2气体中的HCl ③2Na2O2+2CO2===2Na2CO3+O2 ④NaOH溶液 吸收未反应的CO2
⑤把E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气
(2)①合理 由于过氧化钠具有强氧化性,能将+4价的硫氧化为+6价的硫而生成硫酸钠 ②干燥SO2气体,防止水蒸气进入C装置与Na2O2反应 防止空气中的水蒸气和CO2进入C装置与Na2O2反应生成氧气,同时吸收过量SO2气体,便于氧气的检验和防止污染空气 ③ABD


科目:高中化学 来源: 题型:
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:__________________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是________________________________。
(3)吸收液吸收SO2的过程中,pH随n(SO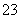 )∶n(HSO
)∶n(HSO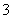 )变化关系如下表:
)变化关系如下表:
| n(SO | 91∶9 | 1∶1 | 1∶91 |
| pH | 8.2 | 7.2 | 6.2 |
上表判断NaHSO3溶液显________性,用化学平衡原理解释:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将NO2装入带活塞的密闭容器中,当反应2NO2(g) 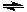 N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是 ( )
N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是 ( )
A.升高温度,气体颜色加深,则此反应为吸热反应
B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅
C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D.恒温恒容时,充入惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅
|
温度/℃ | 1 | 2 | 4 |
| 100 | 1.00 | 0.75 | 0.53 |
| 200 | 1.20 | 0.90 | 0.63 |
| 300 | 1.30 | 1.00 | 0.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:
燃烧热是指通常状况下1 mol纯物质完全燃烧生成稳定的氧化物所放出的热量。下列说法正确的是 )。
A.通常状况下,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则表示氢气燃烧热的热化学方程式为2H2g)+O2g)===2H2Ol) ΔH=-571.6 kJ·mol-1
B.已知:H2g)+F2g)===2HFg) ΔH=-270 kJ·mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ
C.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3g),放热19.3 kJ,其热化学方程式为N2g)+3H2g)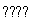 2NH3g) ΔH=-38.6 kJ·mol-1
2NH3g) ΔH=-38.6 kJ·mol-1
D.已知:①Cs,石墨)+O2g)===CO2g) ΔH=-393.5 kJ·mol-1 ②Cs,金刚石)+O2g)===CO2g) ΔH=-395.0 kJ·mol-1,则Cs,金刚石)===Cs,石墨) ΔH=-1.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,体积均为1.5 L的两个恒容容器中发生可逆反应:X2g)+3Y2g)2XY3g) ΔH=-92.6 kJ·mol-1,实验测得有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热46.3 kJ |
| ② | 0.8 | 2.4 | 0.4 | QQ>0) |
下列叙述不正确的是 )。
A.容器①中达到平衡时,Y2的转化率为50%
B.Q=27.78 kJ
C.若容器①体积改为1.0 L,则达平衡时放出的热量大于46.3 kJ
D.容器①、②中反应的平衡常数相等,K=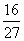
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素A、B、C、D、E,已知A、B为金属,C、D、E为非金属,C是最活泼的非金属,E与C同主族,D离子半径比E离子半径大。A、B的离子与C离子电子层结构相同,其中B离子的半径最小。下列有关说法错误的是
A.含氧酸的酸性: E>D B.原子半径:A>B
C.氢化物的热稳定性:C>E D.离子结合质子能力:D>E
查看答案和解析>>
科目:高中化学 来源: 题型:
重铬酸钾 A是橙红色的固体,有强氧化性。①将其用浓盐酸处理产生黄绿色刺激性气味气体B和蓝紫色溶液C;②在C中加入KOH溶液,先生成灰蓝色沉淀D;③继续加入过量的KOH溶液则沉淀消失,变成绿色溶液E;④在E中加入H2O2加热则生成黄色溶液F,⑤F用稀硫酸酸化,又变成原来的化合物A的溶液。
已知:氢氧化铬在溶液中存在如下平衡:
Cr3++3OH- Cr(OH)3
Cr(OH)3 H2O+HCrO2
H2O+HCrO2 H2O +H++ CrO2-
H2O +H++ CrO2-
蓝紫色 灰蓝色 绿色
(1)根据上述平衡判断氢氧化铬具有____________(填“碱性”、“酸性”、“两性”)。
(2)写出①的离子方程式______________________________________________;
(3)已知D的溶解度为2.06×10-7g ,则D的溶度积常数为______________。
(4)写出③的离子反应方程式________________________________________
(5)④F溶液中的黄色离子是__________(写化学式);若参加反应的H2O2是5mol,则生成的黄色离子的物质的量为__________________。
(6)金属锡(Sn)是第ⅣA的元素,通过下列方法可以测定金属锡样品的纯度:
①将试样溶于盐酸中,发生的反应化学方程式为:__________________________________;
②向①的溶液中再加入过量的FeCl3溶液,发生的反应化学方程式为_________________;
③用已知浓度的A溶液滴定生成的Fe2+。现有金属锡样品wg,经上述各步反应后,用A溶液滴定,A应放在__________(填“酸式”或“碱式”)滴定管中,共用去cmol·L-1的A溶液vmL(锡的相对原子质量用M表示)。求样品中锡的质量分数为_____________(假定杂质不参加反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是( )
A.信息产业中的光缆的主要成分是单质硅
B.利用激光笔可以区别鸡蛋清和浓盐水
C.油脂、糖类、蛋白质都属于天然高分子化合物
D.煤经气化、液化和干馏三个物理变化过程,可变为清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关气体体积的叙述中,正确的是( )
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.气体摩尔体积是指1 mol任何气体所占的体积约为22.4 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com