
| A. | WX2、WZ2分子中所有原子最外层都为8电子结构 | |
| B. | WX2、ZX2的化学键类型和晶体类型都相同 | |
| C. | X的氢化物的熔沸点比Z的氢化物的熔沸点高 | |
| D. | 原子半径大小顺序为X<W<Y<Z |
分析 短周期元素W、X、Y、Z的原子序数依次增大,Y原子的内层电子总数是其最外层电子数的2.5倍,Y有三个电子层,最外层电子数为4,故Y为Si元素;W与Y同主族,则W为C元素;W与X可形成共价化合物WX2,X处于第ⅥA族,X与Z位于同一主族,故X为O元素,Z为S元素,以此进行解答.
解答 解:短周期元素W、X、Y、Z的原子序数依次增大,Y原子的内层电子总数是其最外层电子数的2.5倍,Y有三个电子层,最外层电子数为4,故Y为Si元素;W与Y同主族,则W为C元素;W与X可形成共价化合物WX2,X处于第ⅥA族,X与Z位于同一主族,故X为O元素,Z为S元素,
A.WX2为CO2,二氧化碳分子中,C、O原子都满足8电子稳定结构;WZ2为CS2,C原子最外层4个电子,S原子最外层6个电子,则CS2分子中所有原子最外层都为8电子结构,故A正确;
B.WX2和ZX2分别是二氧化碳和二氧化硫,二氧化碳和二氧化硫都只含共价键,二者的晶体类型都是分子晶体,故B正确;
C.X的氢化物为水,Z的氢化物为硫化氢,由于水分子中含有氢键,导致水的沸点大于硫化氢,故C正确;
D.同周期原子序数越大,原子半径越小,故C>O,Si>S,电子层越多原子半径越大S>C,所以原子半径Si>S>C>O,即X<W<Z<Y,故D错误;
故选D.
点评 本题考查原子结构与元素周期律的应用,为高频考点,题目难度中等,侧重于学生的分析能力的考查,注意把握元素的原子结构特点,熟悉元素及其化合物的性质即可解答,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题

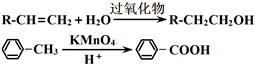

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
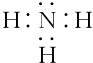 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3分子中氮原子的轨道杂化方式为sp3杂化 | |
| B. | [Cu(NH3)4]2+中,NH3分子是配体 | |
| C. | NH4+与PH4+、CH4、BH4-互为等电子体 | |
| D. | 相同压强下,NH3沸点比PH3的沸点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其最高正价为+3价 | B. | 其最低负价可能为-1价 | ||
| C. | 氢化物溶于水,水溶液一定显酸性 | D. | 其最高价氧化物对应水化物为强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
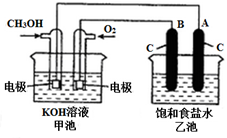 甲醇是一种可再生能源,具有广泛的开发和应用前景.如图是用甲醇燃料电池电解饱和食盐水的装置示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O
甲醇是一种可再生能源,具有广泛的开发和应用前景.如图是用甲醇燃料电池电解饱和食盐水的装置示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com