
【题目】为了探究某固体化合物X(含有3种元素)的组成和性质,设计并完成如下实验,请回答:

已知:气体甲中含有两种气体(组成元素相同),且无色无味。
(1)固体X中含有氧、_________和__________三种元素(写元素符号)
(2)写出X隔绝空气分解的化学方程式___________________________________________;
(3)检验溶液A中最主要金属阳离子的方法是____________________;
(4)由沉淀转化为红棕色固体的一系列操作包括:过滤、_______、灼烧、________和称量。
【答案】C Fe FeC2O4![]() FeO+CO↑+CO2↑ 取少量A溶液于试管,滴加硫氰化钾溶液,无明显现象,再滴加氯水,溶液变血红色,则说明A中含有Fe2+ 洗涤 冷却
FeO+CO↑+CO2↑ 取少量A溶液于试管,滴加硫氰化钾溶液,无明显现象,再滴加氯水,溶液变血红色,则说明A中含有Fe2+ 洗涤 冷却
【解析】
无色气体甲能使澄清石灰水变浑浊,说明甲中含有CO2,甲中含有两种气体(组成元素相同),且无色无味,所以甲中还有CO,CO在标准状况下是2.24L,物质的量是0.1mol,白色沉淀是碳酸钙,碳酸钙的质量是10g,物质的量为0.1mol,CO2的物质的量为0.1mol,所以固体X中含碳元素为0.2mol,红棕色固体是Fe2O3,Fe2O3为8g,物质的量为0.05mol,固体X中含铁元素为0.1mol,X中含O元素的质量为:14.4g-(0.1mol×56g/mol+0.2mol×12 g/mol)=6.4g,O元素的物质的量为0.4 mol,所以X中含有铁元素为0.1mol,碳元素为0.2mol,O元素的物质的量为0.4 mol,故X的化学式为:FeC2O4。
(1)流程中有红棕色固体生成,是Fe2O3,无色气体甲能使澄清石灰水变浑浊,说明甲中含有CO2,根据元素守恒可知X中还含有碳元素和铁元素,故答案为:C ;Fe。
(2)X隔绝空气分解生成的黑色固体是FeO,气体甲中含有两种气体(组成元素相同),且无色无味,所以这两种气体是CO和CO2,反应的方程式为:FeC2O4![]() FeO+CO↑+CO2↑,故答案为:FeC2O4
FeO+CO↑+CO2↑,故答案为:FeC2O4![]() FeO+CO↑+CO2↑。
FeO+CO↑+CO2↑。
(3)Fe2+的检验方法为:取少量A溶液于试管,滴加硫氰化钾溶液,无明显现象,再滴加氯水,溶液变血红色,则说明A中含有Fe2+,故答案为:取少量A溶液于试管,滴加硫氰化钾溶液,无明显现象,再滴加氯水,溶液变血红色,则说明A中含有Fe2+。
(4)沉淀转化为红棕色固体(Fe2O3),具体操作为:过滤、洗涤、灼烧、冷却和称量,故答案为:过滤、洗涤、灼烧、冷却和称量。


科目:高中化学 来源: 题型:
【题目】“一碳化学”是指以研究分子中只含有一个碳原子的化合物(如CO、CO2、CH3OH等)为原料合成一系列化工产品的化学。
(一)工业上,在Cu2O/ZnO作催化剂的条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g) ΔH
CH3OH(g) ΔH
(1)已知:CH3OH(l)=CH3OH (g) ΔH=+35.2 kJ·mol-1,根据下表:
物质 | H2(g) | CO(g) | CH3OH(l) |
燃烧热/kJ·mol-1 | -285.8 | -283.0 | -726.5 |
反应CO(g)+2H2(g)![]() CH3OH(g)的ΔH=_____ kJ·mol-1。
CH3OH(g)的ΔH=_____ kJ·mol-1。
(2)向2L恒容密闭容器中通入1molCO(g)和2molH2(g),发生反应合成甲醇,反应过程中n(CH3OH)与时间(t)及温度的关系如图所示。在500℃恒压条件下,请在图中画出反应体系中n(CH3OH)与时间(t)变化总趋势图________。

(二)CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应:
反应I:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1= -48.5kJ·mol-1
CH3OH(g)+H2O(g) ΔH1= -48.5kJ·mol-1
反应II:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2= +41.2kJ·mol-1
CO(g)+H2O(g) ΔH2= +41.2kJ·mol-1
(3)控制CO2和H2初始投料比为1:3时,温度对CO2平衡转化率及甲醇和CO的产率的影响如图所示:
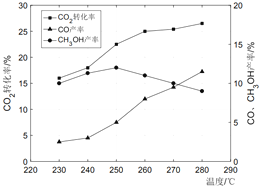
①由图可知温度升高CO产率上升,其主要原因是_____。
②由图可知获取甲醇最适宜的温度是_____。
(4)控制CO2和H2初始投料比为1:1.6,在300℃时,反应I已达到平衡状态,CO2的转化率为50%,甲醇的选择性为60%,此时容器体积为1.0L,若CO2初始加入量为2.0mol,则反应I的平衡常数是_____。
(三)以甲醇为主要原料电化学合成碳酸二甲酯[(CH3O)2CO]的反应原理如下:4CH3OH+2CO+O2![]() 2(CH3O)2CO+2H2O
2(CH3O)2CO+2H2O
(5)由图可知B极为电源_____(填“正”或“负”)极,阳极电极反应式是_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)可作人体补血剂。某同学欲测定补血剂中铁元素的含量,设计了如下实验步骤:

请回答下列问题:
(1)步骤②加入过量H2O2的目的是______________________________。
(2)步骤③加入了足量氨水,反应的离子方程式为__________________________。
(3)步骤④中一系列处理的操作步骤:过滤、________、干燥、灼烧、冷却、称量。
(4)若实验中铁无损耗,则每片补血剂中含铁元素的质量为__________g。
(5)另一位同学认为用酸性KMnO4溶液滴定也能进行铁元素含量的测定,反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、药匙、玻璃棒、量筒、烧杯、胶头滴管外,还需____________________。
②上述实验中的KMnO4溶液需要进行酸化处理,可用于酸化的酸的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种有机物A、B、C互为同分异构体,均由C、H、O三种元素组成,且分子中C、H、O元素的质量比为15:2:8,其相对分子质量通过质谱法测得为100。又知化合物A能发生银镜反应,属于直链结构,分子中有3种不同化学环境的氢,且原子个数比为1:1:2。B为五元环酯。C的红外光谱表明其分子中存在甲基。其它物质的转化关系如下:

完成下列填空:
(1)A的分子式是______________,A分子中的官能团名称是_________________。
(2)B和G的结构简式分别是_____________、_____________。
(3)D→C反应的化学方程式为_________________________________________。
(4)由单体F发生加聚反应生成的产物的结构简式是___________。
(5)试设计一条以![]() 为主要原料制备
为主要原料制备![]() 的合成路线_____,(合成路线常用的表示方式为:甲
的合成路线_____,(合成路线常用的表示方式为:甲![]() 乙
乙![]()
![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一套制取并验证氯气部分化学性质的实验装置。已知:Cl2+2KI=I2+2KCl。

回答下列问题:
(1)装置A中,仪器a的名称叫____,该仪器中盛放的试剂为_____。
(2)装置B的作用是___,当氯气通过一段时间后,B中溶液的pH___7(填“>”“<”或“=”)。
(3)当有少量Cl2通过后,观察到装置C中溶液变成____色。
(4)当Cl2持续通过时,装置D中干燥的有色布条能否褪色?为什么_____。
(5)若要证明Cl2无漂白性,则必须在装置D之前加一个装有____的洗气瓶。
(6)装置E的作用是___,该反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯NOCl可用于合成清洁剂等。它可用Cl2与NO在常温常压下合成:它的熔点为-64.5℃,沸点为-5.5℃,常温下是黄色的有毒气体,遇水易水解。 请按要求回答下列相关问题:
(1)过量铁屑和稀硝酸充分反应制备NO的离子方程式为:______________________。
(2)制备NOCl的装置如下图所示,连接顺序为:a→_________________________(按气流自左向右方向,用小写字母表示)。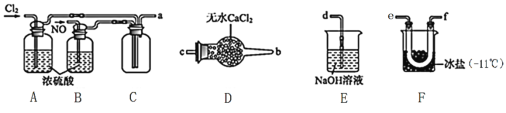
①装置A和B作用是①干燥NO和Cl2,②___________________________________________。
②装置D的作用是______________________________________。
③装置E中NOCl发生反应的化学方程式为________________。
(3)工业生产过程中NO尾气处理方法有多种,其中间接电化学法,其原理如图所示:

该过程中阴极的电极反应式为:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g) + O2(g)![]() 2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t / s | 0 | t1 | t2 | t3 | t4 |
n(SO3) / mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是
A.反应在前t1s 的平均速率v(O2) = 0.4/t1mol·L-1·s-1
B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C.相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10%
D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2是一种清洁能源。在冶金、电力、材料等领域应用广泛。请回答下列问题:
(1)某科研团队利用透氧膜获得N2、H2的工作原理如图甲所示(空气中N2与O2的物质的量之比按4:1计)。上述过程中,膜I侧所得气体的物质的量之比n(H2):n(N2)=3:1,则CH4、H2O与O2反应的化学方程式为______________________。

(2)用H2和CO合成甲醇的热化学方程式为CO(g)+2H2(g) ![]() CH3OH (g) △H1。已知:CO2(g)+3H2(g)==CH3OH(g)+H2O(g) △H2=-49.0kJ·mol-1;CO(g)+H2O(g)==CO2(g)+H2(g) △H3=-41.1k J·mol-1.则△H1=___________ k J·mol-1。
CH3OH (g) △H1。已知:CO2(g)+3H2(g)==CH3OH(g)+H2O(g) △H2=-49.0kJ·mol-1;CO(g)+H2O(g)==CO2(g)+H2(g) △H3=-41.1k J·mol-1.则△H1=___________ k J·mol-1。
(3)向容积可变的密闭容器中充入1 mol CO和2.2molH2,在恒温恒压条件下发生反应CO(g)+2H2(g)![]() CH3OH(g),平衡时,CO的转化率[α(CO)]随温度、压强的变化情况如图乙所示。
CH3OH(g),平衡时,CO的转化率[α(CO)]随温度、压强的变化情况如图乙所示。

①压强:p1___________(填“>”<”或“=”)p2。
②M点时,H2的转化率为___________(计算结果精确到0.1%),该反应的平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③不同温度下,该反应的平衡常数的对数值(lgK)如图丙所示,其中,A点为506K时平衡常数的对数值,则B、C、D、E四点中能正确表示该反应的lgK与温度(T)的关系的是___________。
(4)H2还原NO的反应为2NO(g)+2H2(g)![]() N2(g)+2H2O(1),实验测得反应速率的表达式为v=kcm(NO)·cn(H2)(k是速率常数,只与温度有关)
N2(g)+2H2O(1),实验测得反应速率的表达式为v=kcm(NO)·cn(H2)(k是速率常数,只与温度有关)
①某温度下,反应速率与反应物浓度的变化关系如下表所示。
编号 | c(H2)/(mol/L) | c(NO)/(mol/L) | v/(mol/Lmin) |
1 | 0.10 | 0.10 | 0.414k |
2 | 0.10 | 0.20 | 1.656k |
3 | 0.50 | 0.10 | 2.070k |
由表中数据可知,m=___________,n=___________。
②上述反应分两步进行:i.2NO(g)+H2(g)==N2(g)+H2O2(1)(慢反应);ii.H2O2(1)+H2(g)==2H2O(1)(快反应)。下列叙述正确的是___________(填字母)
A.H2O2是该反应的催化剂
B.反应i的活化能较高
C.总反应速率由反应ii的速率决定
D.反应i中NO和H2的碰撞仅部分有效
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知淀粉、葡萄糖及A、B、C、D、E之间的相互转化关系如下图所示请回答:

(1)B中的官能团名称是___________________A的电子式是_________________。
(2)已知C与D发生加成反应生成E,其化学方程式为_______________________。
(3)下列说法正确的是_____。
A.题中的“某工艺”指的是裂解
B.可用溴的四氯化碳溶液鉴别B和C
C.E不溶于水,能使酸性高锰酸钾溶液褪色
D.A在热Cu丝催化氧化下可生成相对分子质量比它小2的有机物
(4)请补充完整证明反应①是否发生的实验方案:取反应①的溶液2 mL于试管中,______________。(实验中可供选择的试剂:10%的NaOH溶液、5%的CuSO4溶液、碘水)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com