
【题目】某元素的气态氢化物的化学式H2X,该元素最高价氧化物对应水化物的化学式是
A.HXO3B.H3XO4C.H2XO3D.H2XO4
科目:高中化学 来源: 题型:
【题目】关于镁、铝的叙述中不正确的是( )
A、铝是较活泼的金属,能跟盐酸、稀硫酸、氢氧化钠溶液反应放出氢气
B、镁铝合金的强度和硬度都比纯铝和纯镁大
C、在高温下,可以用铝制的容器装运浓硫酸或浓硝酸
D、常温下,铝能和空气里的氧气反应生成一层致密的氧化膜,从而失去光泽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有BaCl2和NaCl的混合溶液VL,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗amolH2SO4、bmolAgNO3。则原混合溶液中的c(Na+)为
A. ![]() mol/L B.
mol/L B. ![]() mol/L C.
mol/L C. ![]() mol/L D.
mol/L D. ![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如图4所示:
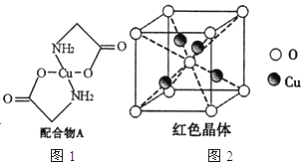
(1)Cu元素基态原子的外围电子排布式为______________。
(2)元素C、N、O的第一电离能由大到小排列顺序为_______________。
(3)配合物A中碳原子的轨道杂化类型为_______________________。
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有![]() 键的数目为____________mol。
键的数目为____________mol。
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:____________(写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图2所示,则该化合物的化学式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列方法制取氢气,反应速率最大的是
A.冬天,块状锌与2 mol·L一1硫酸溶液反应
B.冬天,粉末状锌与2 mol·L一1硫酸溶液反应
C.夏天,块状锌与2 mol·L一1硫酸溶液反应
D.夏天,粉末状锌与2mol·L一1硫酸溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明溶液中只可能大量存在NH4+、Na+、Ag+、Ba2+、MnO4-、Fe3+、CO32-、SO42-、NO3-中的几种离子。从其中取两份各100mL,进行如下实验:
(1)不做任何实验就可以肯定原溶液中不存在的两种离子是_______、_______。
(2)取其中的一份进行实验,加入过量氢氧化钠溶液并加热,生成气体0.06mol。另取其中的一份加入过量Ba(NO3)2溶液,生成白色沉淀4.30 g,过滤,向沉淀中再加入过量稀盐酸,沉淀部分消失,余下沉淀2.33 g。综上所述说明原溶液中肯定存在的各离子浓度分别是(下面填写要求:例如c(Na+)=0.1 mol/L)
_____________、____________、____________、_____________(此空可以不填完)
(3)题干中的MnO4-是化学中的典型强氧化剂,另外生活中常用到的草酸(H2C2O4)是二元弱酸且具有还原性,二者在酸性条件下反应:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+ K2SO4+8H2O,该反应中氧化产物是___________(填名称),请写出该离子方程式并用双线桥标出电子转移的方向与数目:________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效、安全的消毒剂。实验室以NH4Cl、盐酸和NaClO2(亚氯酸钠)为原料制备ClO2的流程如图所示。

请回答下列问题:
(1)ClO2中Cl的化合价是________________________。
(2)写出电解时发生反应的化学方程式:____________________________。
(3)NCl3与NaClO2(亚氯酸钠)反应的化学方程式NCl3+3H2O+6NaC1O2=6ClO2↑+3NaCl+3NaOH+NH3↑,该反应的氧化剂与还原剂的物质的量之比为______;若产生11.2L(标准状况)NH3,则转移电子的总数为___NA。
(4)二氧化氯进行水处理时,除了杀菌消毒外,还能除去水中的Fe3+和Mn2+,写出C1O2将Mn2+氧化为MnO2的离子方程式(C1O2反应后的产物为Cl-):_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镁[MgCO3·Mg(OH)2·3H2O]是重要的化工原料。用橄榄石制取碱式碳酸镁的一种工艺流程如图所示。

已知:阳离子以氢氧化物形式开始沉淀和恰好完全沉淀(阳离子浓度等于10-5mol/L)时的pH如下表所示。
阴离子 | 开始沉淀时的pH | 怡好完全沉淀时的pH |
Fe3+ | 2.7 | 3.7 |
Mg2+ | 9.7 | 11 |
(1)将Mg9FeSi5O20改写成氧化物的形式:___________________。
(2)将橄榄石粉碎的目的是___________________________。
(3)“调节pH”时,应调节的pH范围是________________________。
(4)加入H2O2后发生反应的离子方程式为_____________________________________。
(5)Ksp[Mg(OH)2]=_______。写出生成碱式碳酸镁的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用镁和硝基苯制取反式偶氮苯(溶解性:不溶于水,溶于醇、醚)。实验原理如下:
2![]() +4Mg+8CH3OH→
+4Mg+8CH3OH→ +4Mg(OCH3)2+4H2O
+4Mg(OCH3)2+4H2O
已知:①Mg(OCH3)2在水中极易水解。
②反式偶氮苯产品在紫外线照射后部分转化为顺式偶氮苯。
实验流程如下:

(1)反应中,硝基苯变为反式偶氮苯的反应属于_______________
A、取代反应 B、消去反应 C、还原反应 D、氧化反应
(2)在反应装置中,加入原料及溶剂,搅拌下加热回流。反应加入的镁屑应该_______________________________________。

(3)反应结束后将反应液倒入冰水中,用乙酸中和至中性,即有反式偶氮苯粗产品析出,抽滤(抽滤装置如图1),滤渣用95%乙醇水溶液重结晶提纯。
①为了得到较大颗粒的晶体,加入乙酸时需要____________(填“缓慢加入”、“快速加入”)。
②抽滤过程中要洗涤粗产品,下列液体最合适的是___________。
A.乙醚 B.蒸馏水 C.95%乙醇水溶液 D.饱和NaCl溶液
③抽滤完毕,应先断开橡皮管______________(填序号),以防倒吸。
④重结晶操作包括“加热溶解、趁热过滤、冷却结晶、抽滤、洗涤、干燥”。上述重结晶过程中的________________________操作除去了可溶性杂质。
(4)已知薄层色谱分析中,分子极性弱的物质,在溶剂中扩散更快。某同学采用薄层色谱分析所得偶氮苯,实验开始时和展开后的斑点如图2所示。展开后的斑点中,顺式偶氮苯为______(填斑点序号),说明顺式偶氮苯的分子极性比反式偶氮苯的分子极性__________(填“强”或“弱”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com