
| A. | Fe(OH)3与氢碘酸溶液反应Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 电解MgCl2溶液Mg2++2H2O+2Cl-═Mg(OH)2↓+Cl2↑+H2 | |
| C. | Zn与氯化铵溶液反应生成气体Zn+2NH4+═Zn2++4H2↑+N2↑ | |
| D. | 向明矾的水溶液中滴加足量Ba(OH)2溶液Al3++SO42-+Ba2++4OH-═AlO2-+BaSO4↓+2H2O |
分析 A、Fe(OH)3和HI除了能发生酸碱中和还能发生氧化还原反应;
B、电解氯化镁溶液,实质是电解水和氯化镁;
C、氯化铵溶液中铵根离子水解显酸性,水解出的氢离子能和锌反应;
D、设量少的物质的物质的量为1mol,然后根据需要来确定所消耗的过量物质中的离子的种类和物质的量.
解答 解:A、Fe(OH)3和HI除了能发生酸碱中和还能发生氧化还原反应,生成Fe2+和I2,故离子反应为2I-+2Fe(OH)3+6H+═2Fe2++6H2O+I2,故A错误;
B、镁离子在水溶液中不放电,故电解氯化镁溶液时,在阴极上放电的是水中的氢离子:2H2O+2e-=H2↑+2OH-,阳极上氯离子放电:2Cl--2e-=Cl2,然后镁离子能和OH-生成氢氧化镁沉淀,故电解总反应为:Mg2++2H2O+2Cl-═Mg(OH)2↓+Cl2↑+H2↑,故B正确;
C、氯化铵溶液中铵根离子水解显酸性:NH4++H2O?NH3•H2O+H+,水解出的氢离子能和锌反应:2H++Zn=Zn2++H2↑,氢离子被消耗,导致铵根离子的水解平衡右移,即水解被促进,从而一水合氨能分解生成氨气,故总反应为:Zn+2NH4+═Zn2++H2↑+2NH3↑,故C错误;
D、设量少的明矾的物质的量为1mol,即含1molAl3+和2molSO42-,由于氢氧化钡是足量的,故2molSO42-能消耗2molBa2+生成2mol硫酸钡沉淀,1molAl3+能消耗4molOH-生成1molAlO2-和2molH2O,故离子方程式为:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O,故D错误.
故选B.
点评 本题考查了离子方程式的正确书写,综合性较强,应注意的是过量型离子方程式的书写方法是设量少的为1mol,然后根据需要来确定所消耗的过量物质中的离子的种类和物质的量.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 由于分子间作用力的存在,因而CO2在加热条件下不易发生分解 | |
| B. | 非金属原子间不可能形成离子化合物 | |
| C. | 在PCl3分子中各原子都达到8电子稳定结构 | |
| D. | 离子化合物中可能存在共价键,共价化合物中也可能存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5min内P的平均反应速率为0.15mol/(L•min) | |
| B. | Q的平衡浓度为1mol/L | |
| C. | Q的转化率为25% | |
| D. | x是2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;A、B、D的熔点依次增大的顺序为SiO2>NaF>P4.
;A、B、D的熔点依次增大的顺序为SiO2>NaF>P4.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 混合物 | 分离方法 | 操作过程 | |
| 1 | 从草木灰中提取可溶性物质 | 溶解、过滤 | 将草木灰溶于热水中,不断搅拌, 然后过滤.若滤液仍浑浊,再过滤 |
| 2 | KNO3和NaCl混合物 | 结晶、过滤 | 将混合物溶于热水配成饱和溶液降温,溶液中有KNO3晶体析出,冷却过滤 |
| 3 | 由乙醇溶液制无水乙醇 | 蒸馏 | 加入一定量的生石灰,然后蒸馏 |
| 4 | 除去淀粉溶液中的碘化钠 | 渗析 | 将混合液放入半透膜袋中,并放入流动的蒸馏水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
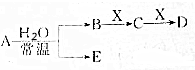 已知A、B、C、D、E、X的转化关系如图所示:
已知A、B、C、D、E、X的转化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
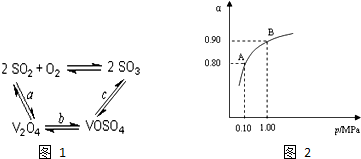 工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列问题:
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列问题:

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
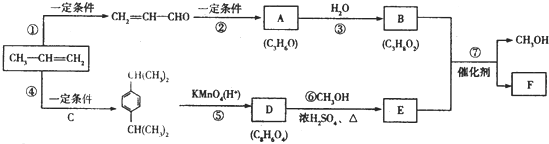
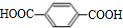 ;F的结构简式为
;F的结构简式为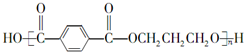 .
.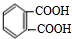 .
.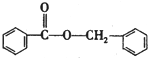 )的合成路线
)的合成路线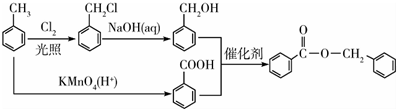 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成SO3 2 mol | B. | SO2和SO3共2 mol | C. | 放出197 kJ热量 | D. | 含氧原子共8 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com