
����Ŀ����һ�������£���H2��N2����һ�ݻ�Ϊ2 L���ܱ������з�����Ӧ����Ӧ������H2��N2��NH3�����ʵ����仯��ͼ��ʾ��

��1����Ӧ����ƽ��״̬��ʱ�����_________________��
��2��ͼ��10��20 min�����߷����仯�Ŀ���ԭ����_______________________________________��
��3����25 min��ƽ��ı��������____________________________________����ʱ����Ӧ����_____����������������С�������������������´�ƽ���NH3�����������ԭƽ��______������������С����������������
��4���жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��___________������ĸ����
a��N2��NH3��Ũ�����
b��NH3�İٷֺ������ֲ���
c�������������ѹǿ����
d��NH3������������H2�������������
e�������л��������ܶȱ��ֲ���
���𰸡�20~25 min��35~40 min (���һ������) ʹ���˴��� �����0.1 mol NH3 ���� С b��c
��������
��1���ﵽƽ��״̬ʱ�����ʵ������䣬�Դ��жϴﵽƽ���ʱ��Σ�
��2����ͼ���֪��������ʵ����仯���죬��10minʱ�������ģ������������ʵ��������ӱ�����ͬ��˵��Ϊʹ�ô�����
��3����25���ӣ�NH3�����ʵ���ͻȻ���٣���H2��N2�����ʵ������䣬˵��Ӧ�Ƿ����NH3��
��4������Ӧ�ﵽ��ѧƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��ٸı䣻
��1����Ӧ����ƽ��״̬ʱ�������ʵ����ʵ���Ũ�ȡ����ʵ����ȱ��ֲ��䣬��ͼ����Կ���20~25 min��35~40 minʱ����ڸ����ʵĵ����ʵ������ֲ��䣬��Ӧ����ƽ��״̬��
�ʴ�Ϊ��20~25 min��35~40 min (���һ������)��
��2����ͼ��֪��0-10��������n(N2) =0.025mol��2=0.05mol��10-20��������n��(N2)=0.025mol��4=0.1mol������֮�ȵ������ʵ���֮�ȣ����ԣ�0-10������10��20��������ʱ����У�N2�ķ�Ӧ����֮��Ϊ0.05mol��0.1mol=1��2����ͼ���֪��������ʵ����仯���죬��10minʱ�仯�������ģ�20min��ƽ��ʱ����n��(N2)=0.025mol��4=0.1mol����n(H2)=0.025mol��12=0.3mol����n(NH3)=0.025mol��8=0.2mol�����ʵ����仯֮�ȵ��ڻ�ѧ������֮�ȣ������������ʵ��������ӱ�����ͬ��˵��10min���ܸı��������ʹ�ô�����
�ʴ�Ϊ��ʹ���˴�����
��3����25���ӣ�NH3�����ʵ���ͻȻ����0.1mol����H2��N2�����ʵ������䣬˵��Ӧ�Ƿ����NH3���������Ũ�ȼ�С��ƽ��������Ӧ������У�����Ӧ���ʼ�С�����´�ƽ���NH3�����������ԭƽ��С��
�ʴ�Ϊ�������0.1 mol NH3�����䣻С��
��4��a. N2��NH3Ũ���Ƿ����ȡ���ڷ�Ӧ����ʼ����ת���ij̶ȣ������ж��Ƿ�ﵽƽ�⣬��a����
b. NH3�ٷֺ������ֲ��䣬˵����Ӧ�ﵽƽ��״̬����b��ȷ��
c. ��Ӧǰ����������ʵ������ȣ������������ѹǿ���䣬˵���ﵽƽ��״̬����c��ȷ��
d. NH3������������H2������������ȣ����淴Ӧ���ʲ��ȣ�û�дﵽƽ��״̬����d����
e. ���������������������������䣬�������Ƿ�ﵽƽ��״̬�������л��������ܶȶ����ֲ��䣬��e����
�ʴ�Ϊ��b��c��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��25��Cʱ��Ksp[Mg(OH)2]=5.61��10-12��Ksp[MgF2]=7.42��10-11,����˵����ȷ����
A.25��Cʱ������Mg(OH)2��Һ�뱥��MgF2��Һ��ȣ�ǰ�ߵ�c(Mg2+)��
B.25��Cʱ����Mg(OH)2������Һ����������NH4Cl���壬c(Mg2+)����
C.25��Cʱ��Mg(OH)2������20mL 0.01 mol/L��ˮ�е�Ksp����20mL 0.01mol/L NH4Cl��Һ�е�KspС
D.25��Cʱ����Mg(OH)2������Һ����ŨNaF��Һ��Mg(OH)2������ת����ΪMgF2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�������������Һ��
�� | �� | �� | �� | �� |
0.1 mol��L-1 CH3COOH��Һ | 0.01mol��L-1 CH3COOH��Һ | pH��2 CH3COOH��Һ | 0.1 mol��L-1 NaOH��Һ | 0.1mol��L-1 ��ˮ |
�ش��������⣺
(1)��Һ��ϡ�͵�ԭ����10�������ҺpH______����Һ��pH������������������������������ͬ��������������Һ��ˮ�������c(H��)����_______��
(2)����ͬ�¶�ʱ100mL ������Һ��10mL ������Һ��Ƚϣ�������ֵǰ�ߴ��ں��ߵ���_______ ������ĸ����
A ���к�ʱ����NaOH���� B ������̶�
C ��ˮ�������c(H��) D�� CH3COOH�����ʵ���
(3)��ˮϡ����ʱ����Һ������ˮ�������Ӷ���С����______������ĸ����
A�� �������������� B��
�������������� B��
C�� c��H+����c��OH-���ij˻������� D��OH-�����ʵ���
(4)������N2H4������ˮ�Լ��ԣ���ԭ���백���ƣ�������Բ��簱ǿ��д��������ˮ�ʼ��Ե����ӷ���ʽ��_______________________________________��
(5)��֪CH3COOH�ĵ���ƽ�ⳣ��Ka=1.8��10��5 ����һ�ֶ�Ԫ����H2B�ĵ���ƽ�ⳣ��ΪK1=4.3��10- 4 ��K2=5.6��10-1 1 ��д����Na2B��Һ�м������CH3COOH��Һ�Ļ�ѧ����ʽ��_________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���һ���ݻ��ɱ�������У�ͨ��3 mol SO2��2 mol O2�����������ʹ֮������Ӧ��2SO2(g)+O2(g) ![]() 2SO3(g)����H=��196.6 kJ��mol-1��һ��ʱ���ﵽƽ�⣬ƽ��ʱ�����������ܵ����ʵ���Ϊ��ʼʱ��90%������˵����ȷ���� �� ��
2SO3(g)����H=��196.6 kJ��mol-1��һ��ʱ���ﵽƽ�⣬ƽ��ʱ�����������ܵ����ʵ���Ϊ��ʼʱ��90%������˵����ȷ���� �� ��
A.�ﵽƽ��ʱSO2��ת����ԼΪ33.3%
B.�ﵽƽ��ʱ��Ӧ�ų�������Ϊ294.9 kJ
C.ƽ��ʱSO3�����ʵ���Ϊ2mol
D.��ƽ��ʱ��O2��ʾ�ķ�Ӧ����Ϊ0.25 mol��L-1��min-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����N��F��S��Cl��Cu��Ni��Ԫ����ɵ����������������������Ź㷺����;���ش��������⣮
��1�����ķ���ϩ��һ�����壬�þ�����һ����ƽ�����������ϸ�����λ����Ķ��ؾ��壮��ͨ��________�������־��塢����ͷǾ��壬![]() �ķ���ϩ�����к�
�ķ���ϩ�����к�![]() ����ĿΪ________��
����ĿΪ________��
��2��![]() ԭ�ӵļ۲���ӹ������ʽ
ԭ�ӵļ۲���ӹ������ʽ![]() �۲�����Ų�ͼ
�۲�����Ų�ͼ![]() Ϊ________��
Ϊ________��
��3��![]() ��Cl��S�縺���ɴ�С��˳��Ϊ________��
��Cl��S�縺���ɴ�С��˳��Ϊ________��
��4��![]() ������
������![]() ��һ�ֳ�ǿ�ᣬ����
��һ�ֳ�ǿ�ᣬ����![]() �Ŀռ乹��Ϊ________������д��һ����
�Ŀռ乹��Ϊ________������д��һ����![]() ������ͬ�ռ乹�ͺͼ�����ʽ�ķ��Ӻ������ӣ�________��________��
������ͬ�ռ乹�ͺͼ�����ʽ�ķ��Ӻ������ӣ�________��________��
��5��![]() �����
�����![]() ����������ʴ�̼������������������ȣ�
����������ʴ�̼������������������ȣ�![]() ������ԭ�ӵ��ӻ�������________��������д���________
������ԭ�ӵ��ӻ�������________��������д���________![]() ����ĸ
����ĸ![]() ��
��
A.���Ӽ�
B.![]() ��
��
C.![]() ��
��
��6��![]() ���ܶ�Ϊ
���ܶ�Ϊ![]() ��CuF�ľ����ṹ����ͼ��CuF�ľ�������
��CuF�ľ����ṹ����ͼ��CuF�ľ�������![]() ________
________![]() �г�����ʽ
�г�����ʽ![]() ��
��
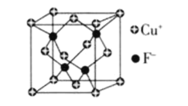
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100��ʱ����0.40 mol���������������һ��2 L��յ��ܱ������У�������Ӧ��2NO2 N2O4��ÿ��һ��ʱ��ͶԸ������ڵ����ʽ��з������õ��±����ݣ�
ʱ��/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
��1�������������£��ӷ�Ӧ��ʼ��20 sʱ����NO2��ʾ��ƽ����Ӧ����Ϊ__________mol��L1��s1��
��2��n3________(����>����<������=��)n4���÷�Ӧ��ƽ�ⳣ��K����ֵΪ___________(��ȷ��0.1)��
��3��������ͬ�����������������г���N2O4��Ҫ�ﵽ����ƽ��״̬��N2O4����ʼŨ����______mol��L1��
��4��������3���ﵽƽ���N2O4��ת����Ϊ______________����������ƽ��Ħ������Ϊ______________��
��5���ﵽƽ�����������¶ȣ�������ɫ�����������¶Ⱥ�Ӧ2NO2N2O4��ƽ�ⳣ����_______________(��������������С������������)��
��6���ﵽƽ����������ܱ��������ٳ���0.32 mol He�����������������Ϊ4 L����ƽ�⽫______________�����������ƶ����������ƶ����������ƶ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӽ���Ĥ�������õ��ȼҵ��ʹ��Ʒ�Ĵ��ȴ����ߣ���Ҫ�鹦�������ӽ���Ĥ���ϸ�ѹأ���ֻ��������������ͨ�����乤��ԭ����ͼ��ʾ��

��1�����ȼҵ�е�ⱥ��ʳ��ˮ�Ʊ�����������������������Һʱ������ʳ��ˮ�����Ӧ����______������C������D������
��2����װ��Ҳ���������ʵ��ᴿ����ҵƷ�������ص���Һ�к���ijЩ����������ʣ���SO42-���������������ӽ���Ĥ���۵���ᴿ����ȥ���ʺ�����������Һ��Һ�����_________������A������B����������
��3�������ӽ���Ĥ�ĵ�������ٽ��˵�ҵ�ķ�չ�����Dz��������룬���������ӽ���ĤҲ�Ѿ�������ͬʱʹ�������ӽ���Ĥ�������ӽ���Ĥ�����������Һ������ͬʱ�Ʊ���Ʒ����������������������Һ��������Һ�������ʡ�ijͬѧ�������ͼ��ʾ��װ�ã�����ָ����������Һ�������_______������C����G������D������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��298Kʱ����20.0mL0.10mol��L-1��ˮ�е���0.10mol��L-1�����ᣬ��Һ��pH����������������ϵ��ͼ��ʾ����֪0.10mol��L-1��ˮ�ĵ����Ϊ1.32%�������й�������ȷ����

A. �õζ�����Ӧ��ѡ���̪��Ϊָʾ��
B. M���Ӧ���������Ϊ20.0mL
C. M�㴦����Һ��c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N�㴦����Һ��pH��12
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ǵ��ƾ��в�ݮ�����ѡ�ӣ�ҡ�����������ζ��ʳ���㾫�����ڷ�����ϴ�Ӽ�����ζ�����ĵ�ζ����ҽҩ��ҵ����Ϊ�л��ϳɵ��м���.�ϳ����������Ĺ�ҵ������ͼ��ʾ��
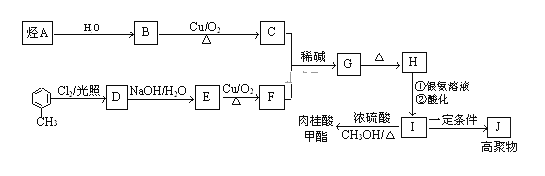
��֪:I.ȩ��ȩ�ܷ�����Ӧ��ԭ�����£�![]() +CH3CHO
+CH3CHO RCH=CH2CHO
RCH=CH2CHO
��.��A�ڱ�״���µ��ܶ�Ϊ1.25g/L��
��ش�
��1��������H�еĹ�����Ϊ__��
��2��A�Ľṹ��ʽΪ__��F�Ľṹ��ʽΪ__��
��3��G��H�ķ�Ӧ����Ϊ__��
��4��д��B��C�Ļ�ѧ��Ӧ����ʽ___��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com