
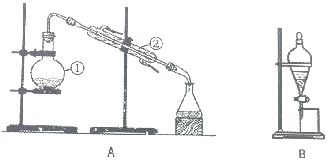
 如图装置是实验室中物质分离的常用装置,请回答下列问题.
如图装置是实验室中物质分离的常用装置,请回答下列问题.分析 (1)装置A为蒸馏操作,其中仪器②起到冷凝作用,名称为冷凝管;蒸馏时必须使用加热仪器,图示装置中缺少酒精灯;给混合液加热时易发生爆沸现象,需要加入碎瓷片防止暴沸;若试验过程中发现忘加碎瓷片,需要停止加热,冷却后重新补加碎瓷片;
(2)可用四氯化碳作催化剂除去碘水中的碘单质;四氯化碳密度较大,有机层在下层、水层在上层,上层液体从分液漏斗的上口倒出;保证液体顺利流下,需要将分液漏斗的玻璃塞打开或使塞上的凹槽对准漏斗上的小孔.
解答 解:(1)根据图示可知,装置A为蒸馏,其中仪器②的名称为冷凝管;蒸馏时需要加热仪器,图示装置中还缺少的仪器为酒精灯;蒸馏时混合液加热易发生爆沸现象,需要加入碎瓷片防暴沸;若试验过程中发现忘加碎瓷片,需要后重新补加碎瓷片,操作方法为:停止实验,待装置冷却至室温时加入碎瓷片,重新开始实验,
故答案为:蒸馏;冷凝管;酒精灯;防暴沸;停止实验,待装置冷却至室温时加入碎瓷片,重新开始实验;
(2)碘单质易溶于CCl4,可用CCl4作催化剂除去碘水中的碘单质;CCl4密度大于水,则有机层在下层、水层在上层,分液时水层应从分液漏斗的上口倒出;
实验过程中为保证液体顺利流下,需要保证分液漏斗内外压强相等,操作方法为:需要将分液漏斗的玻璃塞打开或使塞上的凹槽对准漏斗上的小孔,
故答案为:CCl4;液体分层,下层液体为紫色(液体分层,上层液体为紫色);上;将分液漏斗颈上的玻璃塞打开或使塞上的凹槽对准漏斗上的小孔.
点评 本题考查了物质分离与提纯实验方案的设计,题目难度不大,涉及蒸馏、分液等操作,明确常见化学实验基本操作方法为解答关键,试题有利于提高学生的分析能力及化学实验能力.


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:实验题
| 实验 | 操作 | 现象 |
| ⅰ | 将其置于试管中加稀盐酸、观察 | 无明显现象 |
| ⅱ | 将其置于试管中加足量浓硝酸、观察 | 立即产生红棕色气体 |
| ⅲ | 在ⅱ反应所得溶液中,加Ba(NO3)2溶液、观察,再加BaCl2、观察 | 前者无明显现象,后者出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

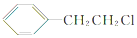 ,B的名称为苯乙烯.
,B的名称为苯乙烯.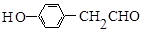 .
.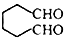 (1,6-己二醛)的合成路线.
(1,6-己二醛)的合成路线.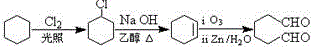
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当生成的沉淀量达到最大时,消耗NaOH 溶液的体积V≥100 mL | |
| B. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是 0.4 mol | |
| C. | 参加反应的金属的总质量 9.6g>m>3.6g | |
| D. | 当金属全部溶解时收集到 NO气体的体积一定为2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用两只量筒分别量取所需氢氧化钠和盐酸 | |
| B. | 两溶液混合后,轻轻搅动溶液,准确读取混合溶液的最高温度 | |
| C. | 仪器装置保温隔热的效果要好,且操作动作要迅速 | |
| D. | 所用的氢氧化钠和盐酸溶液的浓度不宜太大,且体积和浓度均相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com