
(6分)在20L恒容的密闭容器中,加入3mo1SO3(g)和lmo1氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.09 mol·L-1,当反应到8min时,反应到达平衡,此时三氧化硫浓度c(SO3)=" a" mol·L-1。

(1)0min~4min内生成O2平均速率v(O2)= mol·L-1·min-1
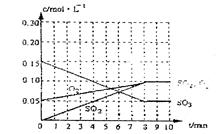
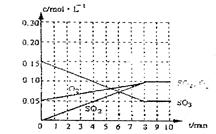
(2)达到平衡时c(O2)=c(SO2),则a= mol·L-1,在下列坐标系中作出0min~8min及之后SO2、O2、SO3浓度随时间变化曲线.
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于a mol·L-1的是
A B C D
SO3 1mol 3mol 3mol 0mol
SO2 2mol 1.5mol 0mol 6mol
O2 2mol 1mol 0mol 5mol
(1) 0.01mol/L. min(1分)
(2) a="0.05" mol/L (1分) 图象如右(2分)
(3) BD
【解析】
试题分析: 利用三行式求解
2SO3 ? 2SO2 + O2
起始物质的量浓度 3/20 0 1/20
变化物质的量浓度 0.08 0.08 0.04
4Min物质的量浓度 0.07 0.08 0.09
所以(1)0min~4min内生成O2平均速率v(O2)= 0.01mol/L. min
利用三行式求解
2SO3 ? 2SO2 + O2
起始物质的量浓度 3/20 0 1/20
变化物质的量浓度 2x 2x x
8Min平衡物质的量浓度 a =0.15-2x 2x 0.05- x
达到平衡时c(O2)=c(SO2)即 2x = 0.05- x 所以 x=0.05 所以a =0.15-2x=0.05
(2)达到平衡时c(O2)=c(SO2),则a="0.05" mol/L,在下列坐标系中作出0min~8min及之后SO2、O2、SO3浓度随时间变化曲线
考点:化学平衡 等效平衡 化学反应速率
点评:对于化学平衡的计算学生必须要掌握的知识有:三行式; 化学反应速率的计算公式:v=Δc/Δt ;等效平衡的三种情况:
I类:恒温恒容下对于反应前后气体体积发生变化的反应来说(即△V≠0的体系):等价转化后,对应各物质起始投料的物质的量与原平衡起始态相同。
II类:恒温恒容下对于反应前后气体体积没有变化的反应来说(即△V=0的体系):等价转化后,只要反应物(或生成物)的物质的量的比例与原平衡起始态相同,两平衡等效。
III类:恒温恒压下对于气体体系等效转化后,只要反应物(或生成物)的物质的量的比例与原平衡起始态相同,两平衡等效。


科目:高中化学 来源: 题型:
 在20L恒容的密闭容器中,加入3molSO3(g)和1mol氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.09mol?L-1,当反应到8min时,反应到达平衡,此时三氧化硫浓度c(SO3):a mol?L-1.
在20L恒容的密闭容器中,加入3molSO3(g)和1mol氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.09mol?L-1,当反应到8min时,反应到达平衡,此时三氧化硫浓度c(SO3):a mol?L-1.

| A | B | C | D | |
| SO3 | 1mol | 3mol | 3mol | 0mol |
| SO2 | 2mol | 1.5mol | 0mol | 6mol |
| O2 | 2mol | 1mol | 0mol | 5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在20L恒容的密闭容器中,加入3molSO3(g)和1mol氧气,在某温度下使其反应,反应至4min时,氧气的浓度为0.06mol/L,当反应到8min时,反应到达平衡.
在20L恒容的密闭容器中,加入3molSO3(g)和1mol氧气,在某温度下使其反应,反应至4min时,氧气的浓度为0.06mol/L,当反应到8min时,反应到达平衡.| A | B | C | D | |
| SO3 | 1mol | 3mol | 3mol | 0mol |
| SO2 | 2mol | 1.5mol | 0mol | 6mol |
| O2 | 2mol | 1mol | 0mol | 5mol |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁省丹东市宽甸二中高二上学期期末考试化学试卷(带解析) 题型:填空题
(6分)在20L恒容的密闭容器中,加入3mo1SO3(g)和lmo1氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.09 mol·L-1,当反应到8min时,反应到达平衡,此时三氧化硫浓度c(SO3)=" a" mol·L-1。
(1)0min~4min内生成O2平均速率v(O2)= mol·L-1·min-1
(2)达到平衡时c(O2)=c(SO2),则a= mol·L-1,在下列坐标系中作出0min~8min及之后SO2、O2、SO3浓度随时间变化曲线.
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于a mol·L-1的是
| | A | B | C | D |
| SO3 | 1mol | 3mol | 3mol | 0mol |
| SO2 | 2mol | 1.5mol | 0mol | 6mol |
| O2 | 2mol | 1mol | 0mol | 5mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| A | B | C | D | |
| SO3 | 1mol | 3mol | 3mol | 0mol |
| SO2 | 2mol | 1.5mol | 0mol | 6mol |
| O2 | 2mol | 1mol | 0mol | 5mol |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com