
| A. | 2.4g Mg与N2完全反应,转移电子数都是0.3NA | |
| B. | 1mol白磷分子中含有P-P键数为1.5NA | |
| C. | 1.7gH2O2中含有的电子数为0.9NA | |
| D. | 在18g 18O2中含有2NA个氧原子 |
分析 A、求出镁的物质的量,然后根据1mol镁转移2mol电子来分析;
B、白磷分子中含有6个P-P键,所以1mol白磷分子中含有6molP-P键;
C、求出双氧水的物质的量,然后根据1mol双氧水中含18mol电子来分析;
D、求出18g18O2的物质的量,然后根据1mol18O2中含2mol氧原子来分析.
解答 解:A、2.4g金属镁的物质的量为0.1mol,而与氮气反应后镁变为+2价,1mol镁失去2mol电子,故0.1mol镁失去0.2mol电子,即0.2NA个,故A错误;
B、白磷分子为正四面体结构,1分子白磷中含有6molP-P键,所以1mol白磷分子中含有6molP-P键,故B错误;
C、1.7g双氧水的物质的量n=$\frac{1.7g}{34g/mol}$=0.05mol,而1mol双氧水中含18mol电子,则0.05mol双氧水中含0.9mol电子,即0.9NA个,故C正确;
D、18g18O2的物质的量n=$\frac{18g}{36g/mol}$=0.5mol,而1mol18O2中含2mol氧原子,即0.5mol中含1mol氧原子,即NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的运用和物质的结构特点是解题关键,难度不大.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:多选题
| A. | 向能使PH试纸显深蓝色的溶液中通入少量二氧化碳:OH-+CO2═HCO3- | |
| B. | 向NaClO溶液中加入浓氢溴酸:ClO-+2H++2 Br-═Cl-+Br2+H2O | |
| C. | 向NaClO溶液中通入少量二氧化碳:2ClO-+CO2+H2O═2HClO+CO32- | |
| D. | 向FeBr2溶液中滴加少量HClO溶液:2Fe2++HClO═2Fe3++Cl-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Y、z为同周期金属元素,Y、Z的最高价氧化物对应水化物可以反应生成盐和水.回答下列问题:
Y、z为同周期金属元素,Y、Z的最高价氧化物对应水化物可以反应生成盐和水.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 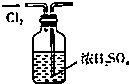 干燥Cl2 干燥Cl2 | B. |  吸收HCl | C. | 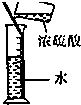 稀释浓H2SO4 | D. | 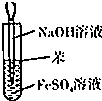 制取Fe(OH)2沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 木糖醇与核糖(C3H10O3)互为同分异构体 | |
| B. | 木糖醇与甘油(CH2OHCHOHCH2OH)互为同系物 | |
| C. | 木糖醇可以与乙酸发生酯化反应 | |
| D. | 木糖醇与葡萄一样是一种单糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ②④ | C. | ②⑤ | D. | ①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
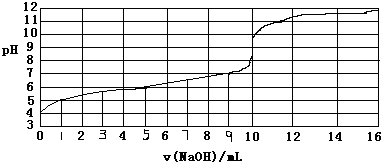
| A. | 此实验可以选用酚酞作指示剂 | |
| B. | 弱酸HA的浓度约为1×10-4mol/L | |
| C. | 根据已知条件,弱酸HA的电离常数(Ka)不能计算 | |
| D. | 当NaOH体积为9ml时,恰好完全中和反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com