
����Ŀ��������Ԫ��W��X��Y��Z��ԭ��������������m��p��q��r��s������ЩԪ����ɵĶ�Ԫ��������³�ѹ��r ΪҺ�壬�����Ϊ��ɫ���壬m��Ħ������Ϊp��2����n��Ԫ��Y�ĵ��ʣ�q��ʹƷ����Һ��ɫ��������ת����ϵ��ͼ��ʾ������˵���в���ȷ����( )
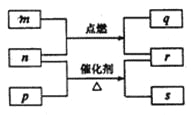
A. ԭ�Ӱ뾶��Y< X< Z B. �ǽ����ԣ�Y> X> W
C. m��q��n��s�����ܹ��� D. ��n������q�����Լ���ȼ��
���𰸡�D
�����������������������Ԫ��W��X��Y��Z��ԭ�������������ӡ�m��p��q��r������ЩԪ����ɵĶ�Ԫ��������³�ѹ��r ΪҺ�壬�����Ϊ��ɫ���壬���rˮH2O��m��Ħ������Ϊp��2����n��Ԫ��Y�ĵ��ʣ�q��ʹƷ����Һ��ɫ����q��SO2������ת����ϵͼ�ж�m��H2S��n��������p��NH3��s��NO������W��X��Y��Z�ֱ���H��N��O��S��A������Ԫ�������ɵ�ԭ�Ӱ뾶�仯���ɣ�ͬһ���ڵ�Ԫ�أ�ԭ������Խ��ԭ�Ӱ뾶ԽС��ͬһ�����Ԫ�أ�ԭ�Ӻ�����Ӳ���Խ�࣬ԭ�Ӱ뾶Խ����ԭ�Ӱ뾶�Ĵ�СY<X<Z��A��ȷ��B��ͬһ����Ԫ�أ�����ԭ��������������������Ԫ�صķǽ���������ǿ��ͬ����Ԫ�����϶��£�����ԭ������������Ԫ�صķǽ�������������Ԫ�صķǽ�����Y>X>W��B��ȷ��C��H2S��SO2���Լ�������NO�����ܴ������棬C��ȷ��D�������������������£�H2Sȼ������SO2��ˮ���ò�����������D����ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�к��нϴ�����Cl����CO![]() ��OH����3�������ӣ����ֻȡһ�θ���Һ���ܹ��ֱ�3�����������μ������������ʵ�����˳����ȷ����( )
��OH����3�������ӣ����ֻȡһ�θ���Һ���ܹ��ֱ�3�����������μ������������ʵ�����˳����ȷ����( )
���μ�Mg(NO3)2��Һ ������ ���μ�AgNO3��Һ ���μ�Ba(NO3)2��Һ
A���٢ڢܢڢ� B���ܢڢ٢ڢ� C���٢ڢۢڢ� D���ܢڢۢڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����з�ӦII��CO2(g)+H2(g)![]() CO(g)+H2O(g) ��H>0����ͼ��ʾ��ӦII��t1ʱ�̴ﵽƽ�⣬��t2ʱ����ı�ij�������������仯���������ͼ��t2ʱ�̷����ı������������ ��
CO(g)+H2O(g) ��H>0����ͼ��ʾ��ӦII��t1ʱ�̴ﵽƽ�⣬��t2ʱ����ı�ij�������������仯���������ͼ��t2ʱ�̷����ı������������ ��
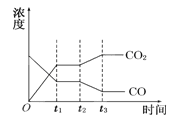
A�����¶� B�����¶� C������� D����ѹǿ
E��Сѹǿ F����CO2 G���������CO
��2������β����������Ҫԭ��Ϊ��2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ��H<0
2CO2(g)+N2(g) ��H<0
�ں����ܱ������з����÷�Ӧʱ��c(CO2)���¶�(T)�������ı����(S)��ʱ��(t)�ı仯���ߣ���ͼ��ʾ�����������������һ��ʱ�����������������ѧ��Ӧ���ʡ��������ı����S1��S2����ͼ�л���c(CO2)��T2��S2�����´ﵽƽ������еı仯���ߡ�
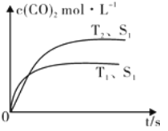
��3���״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������ҵ��һ��������з�Ӧ�ϳɼ״���
��ӦI��CO(g)+2H2(g)![]() CH3OH(g) ��H1
CH3OH(g) ��H1
���±����������Ƿ�ӳI�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
�¶� | 250�� | 300�� | 350�� |
K | 2.041 | 0.270 | 0.012 |
�ɱ��������ж���H1 ������������=��������������
��ij�¶��£���2molCO��6molH2����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c(CO)=0.2mol/L����������ʽ����ƽ�ⳣ���������ʱ���¶ȡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�ʾ��Ӧ��ѧ��Ӧ�����ӷ���ʽ��ȷ����( )
A����KIO3����������Һ�е�KI��5I-+IO3-+3H2O=3I2+6OH-
B����NH4HCO3��Һ�мӹ���NaOH��Һ�����ȣ�NH4++OH-![]() NH3��+H2O
NH3��+H2O
C��������SO2ͨ�백ˮ�У�SO2+NH3��H2O=HSO3-+NH4+
D. Ba(OH)2��Һ�м���NaHSO4��Һ��������ȫ��Ba2++2OH-+2H++SO42-=BaSO4��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڳ����ʵ�ʵ������У�Ϊ�˽���Һ�е�������ȫȥ����ͨ�����������ij������Լ���ijУ��ѧ����С��Ϊ�˳�ȥ�����к�������Na2SO4��MgCl2�����������ʵ�鲽�裺
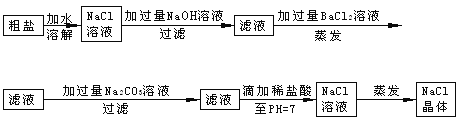
�Լ�Ҫ˵��
��1���������BaCl2����Һ��ԭ��____ ___ ��
��2���������Na2CO3����Һ��ԭ��______ ___ _��
��3���μ�ϡ����ֱ��pH=7��Ŀ����____ ___ _ _��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݱ��������Ħ��������˾�з���һ���ɼ״��������Լ�ǿ�����������Һ�������ֻ���أ������ɴ�����ʹ�õ������ػ�﮵�ص�ʮ����������ʹ��һ���²ų�һ�ε硣���ط�ӦΪ��2CH3OH + 3O2+ 4OH-![]() 2CO32-+6H2O��������˵����ȷ����
2CO32-+6H2O��������˵����ȷ����
A. ���ɸõ�ص������������������ֻ��Բ�ͬ�Ľ���
B. ���ʱ��CH3OH���ɵĵ缫Ϊ����
C. �ŵ�ʱ�������Һ��pH������
D. �ŵ�ʱ�����ĵ缫��ӦΪ��CH3OH��6e����8OH���� CO32-+ 6H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ij��̬�����ﻯѧʽΪRO2���ڱ�״���£�1.28 g������������Ϊ448 mL������������Ħ������Ϊ___________��R�����ԭ������Ϊ________��
��2����֪CO��CO2�Ļ�����������Ϊ15 g���ڱ�״�������Ϊ8.8 L�������֪�û�������к�CO________ g������CO2�ڱ�״�������Ϊ________ L��
��3����4 g NaOH����________gˮ�У�����ʹÿ100��ˮ����������1��Na����
��4��ͬ��ͬѹ��SO2 ��He�ܶ�֮��Ϊ ����������ȣ�������������֮��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС���о�Ӱ�췴Ӧ���ʵ����ء�
��1��ʵ��һ��̽�����ǿ��������þ����Ӧ���ʵ�Ӱ�졣
�����ʵ�鷽�����±�������c = mol��L��1��
��� | ������� | ���Ũ��/mol��L��1 | ������/ml | þ������/g |
1 | ���� | 1.0 | 10 | 2.0 |
2 | ���� | c | 10 | 2.0 |
��ʵ�鲽�裺
��a�����װ�ã���ͼ���������Ժ�����ҩƷ��
��b����Ӧ��ʼ�� ��
��c��������¼������ת��Ϊ����ͼ����ͼ����
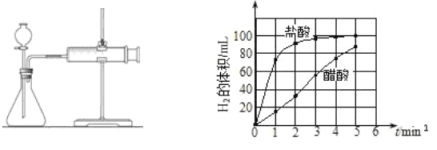
��д��0��5min���ᡢ������þ����Ӧ�ķ�Ӧ���ʱ仯���ɣ� ��
��2��ʵ�����̽����Ӧ������0.10mol/LNa2S2O3��Һ��ϡH2SO4��Ӧ���ʵ�Ӱ�죬�������ⶨ������£�
��� | ��Ӧ�¶�/�� | Na2S2O3��Һ/ml | V(����ˮ)/ml | 0.10mol/LH2SO4��Һ/ml | �� |
1 | 25�� | 10.0 | 0 | 10.0 | |
2 | 25�� | 5.0 | a | 10.0 | |
3 | 45�� | 10.0 | 0 | 10.0 |
I.�������ʵ��ԭ�������ӷ���ʽ ��
II.����ʵ��1��3��̽�� �Ի�ѧ��Ӧ���ʵ�Ӱ�죻������ʵ��1��2��̽��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬aΪ ������ʵ����Ҫ���������������������������Ӧ��д ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A��������ͬŨ�ȵ�����HX��HY��ǰ�ߵ�Ka��С����Һ����ˮϡ����ͬ����ʱ��HY��Һ��pH�ı�ֵ����HX��Һ��pH�ı�ֵ
B����NH3��H2O��NH4ClŨ�Ⱦ�Ϊ0.1 mol��L-1����ϵ�У������������ʱ����Һ��pH�ɱ��ֻ�������
C����NaH2PO4ˮ��Һ�д��ڹ�ϵ��c(H3PO4) + c(H+) = c(HPO42-) + c(PO43-) + c(OH-)
D�������ܽ�ƽ��AgI ![]() Ag+ + I- ��ƽ�ⳣ��Ϊ8.5��10-17������˵��������AgI���������
Ag+ + I- ��ƽ�ⳣ��Ϊ8.5��10-17������˵��������AgI���������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com