
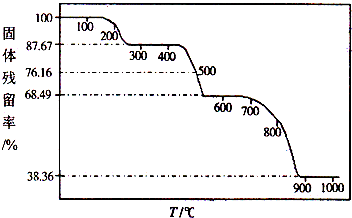
| 固体样品的剩余质量 |
| 固体样品的起始质量 |
| Ksp |
| c(C2O42-) |
| 2.34×10-9 |
| 1.0×10-5 |
| 87.67g×146 |
| 100g |
| 38.36g×146 |
| 100g |
| 146g×68.49g |
| 100g |
| 36.5g |
| 146g/mol |


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
| A、6个 | B、8个 | C、9个 | D、12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
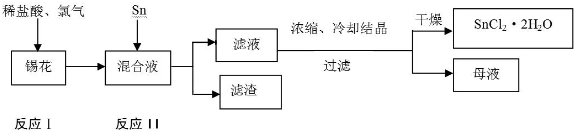
查看答案和解析>>
科目:高中化学 来源: 题型:
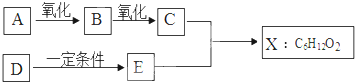
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


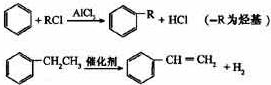 利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Cl-)=c(NH4+)>c(OH-)>c(H+) |
| B、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| D、c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n (NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com