
| A. | 气态氢化物的稳定性:D>C | B. | 原子序数:b>a>c>d | ||
| C. | 离子的还原性:cCn->dD(n+1)- | D. | 离子的氧化性:aAn+>bB(n+1)+ |
分析 已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),则有A、B在周期表中C、D的下一周期,并且原子序数:b>a>c>d,由离子所带电荷,可知A、B属于金属元素,C、D属于非金属性元素.
A.非金属性越强,对应氢化物越稳定;
B.根据核外电子数相等判断原子序数;
C.非金属性越强,阴离子还原性越弱;
D.金属性越强,阳离子影响越弱.
解答 解:已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),则有A、B在周期表中C、D的下一周期,并且原子序数:b>a>c>d,由离子所带电荷,可知A、B属于金属元素,C、D属于非金属性元素,则:
A.C、D在同一周期,且原子序数C>D,非金属性:C>D,则气态氢化物的稳定性:C>D,故A错误;
B.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),则有原子序数:b>a>c>d,故B正确;
C.非金属性:C>D,则离子的还原性:cCn-<dD(n+1)-,故C错误;
D.A、B在周期表中同周期,原子序数:b>a,金属性:A>B,则离子的氧化性:aAn+<bB(n+1)+,故D错误,
故选:B.
点评 本题考查位置结构性质关系及应用,关键是根据核外电子排布确定元素所在周期表中的相对位置,注意对元素周期律的理解掌握,难度不大.


科目:高中化学 来源: 题型:解答题
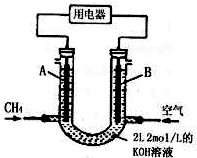 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O | |
| C. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组别 | 化学方程式 | 结论 |
| I | 6CO2+6H2O═C6H12O6+6O2 CO2+H2O═H2CO3 | 反应物相同,生成物不同, 原因反应条件不同. |
| Ⅱ | Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O | 反应物相同,生成物不同, 原因反应物的浓度不同. |
| Ⅲ | C+O2(充足)$\frac{\underline{\;点燃\;}}{\;}$CO2 2C+O2(不充足)$\frac{\underline{\;点燃\;}}{\;}$2CO | 反应物相同,生成物不同, 原因反应物的量不同. |
| Ⅳ | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑(反应缓慢) 2KClO3 $→_{加热}^{二氧化锰}$2KCl+3O2↑(反应迅速) | 反应物相同,反应速率不同, 原因有无催化剂. |
| 实践与应用 | 科学探究正努力实现对化学反应的控制,很多化学家致力于研究二氧化碳的“组合转化”技术,把过多二氧化碳转化为有益于人类的物质.若让二氧化碳和氢气在一定条件下反应,可生成一种重要的化工原料,反应的化学方程式如下: 2CO2+6H2$\frac{\underline{\;催化剂\;}}{△}$X+4H2O,推断X的化学式是C2H4. | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机物CH2=CHCH(CH3)CH2CH3和氢气加成后的产物的一氯取代物有3种 | |
| B. |  表示苯的分子结构,其中含有碳碳双键,因此苯的性质跟乙烯相同 表示苯的分子结构,其中含有碳碳双键,因此苯的性质跟乙烯相同 | |
| C. | 乙烯使溴水褪色和苯与溴水混合振荡后水层变为无色原理相同 | |
| D. | CH2Cl2是纯净物,说明甲烷是正四面体形结构而不是平面正方形结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③④⑤ | C. | ①③④⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升温 | B. | c(A)增大 | C. | C(C)降低 | D. | C(A)降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com