
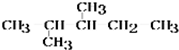
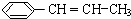 )在催化剂作用下生成聚苯丙烯的反应方程式:
)在催化剂作用下生成聚苯丙烯的反应方程式: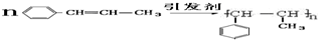
 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O.
+3H2O. 分析 (1)有机物主链含有5个C原子,有2个甲基,分别位于2、3碳原子上;
(2)在碳架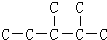 中添加碳碳双键,总共存在5种不同的添加方式,所以该烯烃存在5种同分异构体;
中添加碳碳双键,总共存在5种不同的添加方式,所以该烯烃存在5种同分异构体;
(3)若此烷烃为炔烃加氢制得,在该碳架上碳架碳碳三键,只有一种方式,所以此炔烃的结构简式为: ;
;
(4)碳架为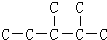 的烷烃中含有6种等效氢原子,所以该烷烃含有6种一氯代烷;
的烷烃中含有6种等效氢原子,所以该烷烃含有6种一氯代烷;
(5)苯丙烯含有碳碳双键,可发生加聚反应生成聚苯乙烯;
(6)在浓硫酸作催化剂、加热条件下,甲苯和硝酸发生取代反应生成TNT.
解答 解:(1)有机物主链含有5个C原子,有2个甲基,分别位于2、3碳原子上,烷烃的名称为2,3-二甲基戊烷,故答案为:2,3-二甲基戊烷;
(2)在碳架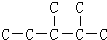 中添加碳碳双键,总共存在5种不同的添加方式,所以该烯烃存在5种同分异构体,故答案为:5;
中添加碳碳双键,总共存在5种不同的添加方式,所以该烯烃存在5种同分异构体,故答案为:5;
(3)若此烷烃为炔烃加氢制得,在该碳架上碳架碳碳三键,只有一种方式,所以此炔烃的结构简式为: ,故答案为:1;
,故答案为:1;
(4)碳架为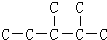 的烷烃中含有6种等效氢原子,所以该烷烃含有6种一氯代烷,故答案为:6;
的烷烃中含有6种等效氢原子,所以该烷烃含有6种一氯代烷,故答案为:6;
(5)苯丙烯中含C=C,可发生加聚反应,该加聚反应为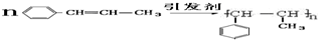 ,
,
故答案为: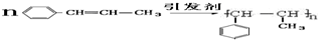 ;
;
(6)甲苯和硝酸在浓硫酸作催化剂、加热条件下发生取代反应生成TNT,反应的化学方程式为: +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O,
+3H2O,
故答案为: +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O.
+3H2O.
点评 本题考查了有机物的结构和性质,侧重于同分异构体的书写、常见有机物结构与性质的考查,题目难度中等,注意掌握同分异构体的概念及书写方法,试题培养了学生灵活应用所学知识的能力.


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释 |
| A | N原子的第一电离能大于O原子 | N原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C=O之间的夹角为120° |
| C | H2O的沸点大于H2S的沸点 | H2O是液态的,H2S是气态的 |
| D | HF比HCl稳定 | HF分子间可以形成氢键 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
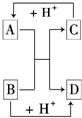 已知A、B、C、D是中学化学中常见的四种不同粒子.它们之间存在如图所示的转化关系.
已知A、B、C、D是中学化学中常见的四种不同粒子.它们之间存在如图所示的转化关系.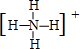 ,D的电子式
,D的电子式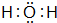 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
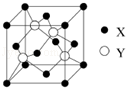 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p 轨道上有4个电子.元素Z 的原子最外层电子数是其内层的3倍.
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p 轨道上有4个电子.元素Z 的原子最外层电子数是其内层的3倍.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; .
. ;
; .
. →
→ ;
;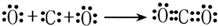 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com