
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.50 | 20.00 |
| 2 | 0.10 | 18.56 | 20.00 |
| 3 | 0.10 | 18.54 | 20.00 |
分析 ①根据滴定管的结构和精确度以及测量的原理;如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
②先判断数据的合理性,求出标准NaOH溶液体积,然后依据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$求出即可;
③氢氧化钠为碱性物质,应选择碱式滴定管乙;
④依据(2)中公式,分析不当操作对V(标准)的影响,不当操作导致消耗标准液偏多的,结果偏大,否则偏小,以此判断浓度的误差.
解答 解:①滴定管小数在上,大数在下,精确度为0.01mL,所以第一次实验滴定完用去NaOH溶液的体积22.50mL;滴定时,当溶液颜色变化且半分钟内不变色,可说明达到滴定终点,即酚酞在酸中为无色,在碱性溶液中显浅红色;
故答案为:22.50mL;当滴入最后一滴氢氧化钠溶液时,溶液由无色恰好变成浅红色,且半分钟内不褪色;
②舍去误差较大的数,得出V(标准)=$\frac{18.56+18.54}{2}$=18.55mL,c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$=0.093mol/L;
故答案为:0.093mol/L;
③氢氧化钠为碱性物质,应选择碱式滴定管乙;
故答案为:乙;
④A、滴定终点读数时俯视读数,造成标准液偏小,根据c(待测)公式分析,结果偏小,故不选;
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗,导致消耗的标准液体积偏小,结果偏小,故不选;
C、锥形瓶水洗后未干燥,对消耗标准液的体积无影响,结果准确,故不选;
D、称量前NaOH固体中混有Na2CO3固体,等质量的碳酸钠和氢氧化钠,碳酸钠消耗的盐酸偏低,在滴定时消耗的标准液体积偏大,导致消耗的标准液偏多,结果偏大,故选;
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3,等物质的量的碳酸钠与氢氧化钠消耗的氯化氢相等,滴定时消耗的标准液体积不变,测定结果不变,故不选;
F、碱式滴定管尖嘴部分有气泡,滴定后消失,导致消耗的标准液体积读数偏大,故选;
故选:D、F.
点评 本题考查了酸碱中和滴定实验及误差分析,掌握中和滴定的操作方法及完成分析的方法是解题关键,注意依据公式c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$进行误差分析,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
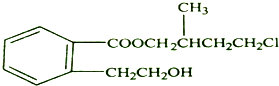
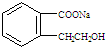 .
.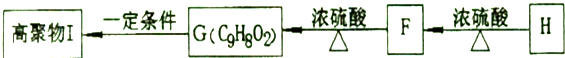
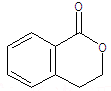 .②由F生成的G化学方程式
.②由F生成的G化学方程式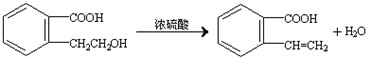 .
.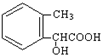 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | FeCl3溶液与Cu粉反应:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 氯气与水反应:Cl2+H2O?2H++Cl-+ClO- | |
| D. | 氯化铝溶液与过量氨水反应:3NH3•H2O+Al3+=Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体的体积和体系的压强 | B. | 溶液颜色的深浅 | ||
| C. | 固体物质的体积 | D. | H+浓度的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组设计了一组实验,验证元素周期律.
某研究性学习小组设计了一组实验,验证元素周期律.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
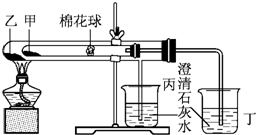 下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验.请观察下图的实验装置,分析实验原理,回答下列问题:
下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验.请观察下图的实验装置,分析实验原理,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
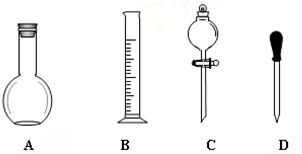 实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com