
【题目】K3[Fe(C2O4)3]·3H2O[三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用铁屑为原料制备,相关反应的化学方程式为:Fe+H2SO4=FeSO4+H2↑、FeSO4+H2C2O4+2H2O=FeC2O4·2H2O↓+H2SO4、2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O、2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O。回答下列问题:
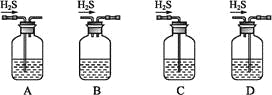
(1)铁屑中常含硫元素,因而在制备FeSO4时会产生有毒的H2S气体,该气体可用氢氧化钠溶液吸收。下列吸收装置正确的是_____。
(2)在将Fe2+氧化的过程中,需控制溶液温度不高于40 ℃,理由是_______;得到K3[Fe(C2O4)3]溶液后,加入乙醇的理由是________。
(3)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤__________(叙述此步操作),⑥计算。步骤③若未在干燥器中进行,测得的晶体中所含结晶水含量____(填“偏高”“偏低”或“无影响”);步骤⑤的目的是_______________。
(4)晶体中C2O42-含量的测定可用酸性KMnO4标准溶液滴定。称取三草酸合铁(Ⅲ)酸钾晶体m g溶于水配成250 mL溶液,取出20.00 mL放入锥形瓶中,用0.010 0 mol·L-1酸化的高锰酸钾溶液进行滴定。
①下列操作及说法正确的是___。
A.滴定管用蒸馏水洗涤后,即可装入标准溶液
B.装入标准溶液后,把滴定管夹在滴定管夹上,轻轻转动活塞,放出少量标准液,使尖嘴充满液体
C.接近终点时,需用蒸馏水冲洗瓶壁和滴定管尖端悬挂的液滴
②有同学认为该滴定过程不需要指示剂,那么滴定终点的现象为________,若达到滴定终点消耗高锰酸钾溶液V mL,那么晶体中所含C2O42-的质量分数为____(用含V、m的式子表示)。
【答案】A 防止H2O2分解 三草酸合铁(Ⅲ)酸钾在乙醇中溶解度小 重复②~④步操作至恒重 偏低 检验晶体中的结晶水是否已全部失去 B 当滴入最后一滴KMnO4溶液,锥形瓶中溶液恰好由无色变为浅红色,且半分钟不褪色 ![]()
【解析】
(1)A.该装置中硫化氢与氢氧化钠溶液接触面积大,从而使硫化氢吸收较完全,且该装置中气压较稳定,不产生安全问题,故A正确;
B.硫化氢与氢氧化钠接触面积较小,所以吸收不完全,故B错误;
C.没有排气装置,导致该装置内气压增大而产生安全事故,故C错误;
D.该装置中应遵循“长进短出”的原理,故D错误;
故选A;
(2)双氧水不稳定,温度高时,双氧水易分解,为防止双氧水分解,温度应低些;根据相似相溶原理知,三草酸合铁酸钾在乙醇中溶解度小,所以得到K3[Fe(C2O4)3]溶液后,再想获得其晶体,常加入无水乙醇;
(3)晶体中所含结晶水可通过重量分析法测定,步骤⑤的目的是检验晶体中的结晶水是否已全部失去,也叫恒重操作;步骤③未在干燥器中进行,晶体中结晶水不能全部失去,所以称量出的水的质量偏小,测得的晶体中所含结晶水含量也偏低;
(4)①A.滴定管用蒸馏水洗涤后,需要用标准液润洗,然后在装入标准溶液,A错误;
B.装入标准溶液后,把滴定管夹在滴定管夹上,轻轻转动活塞,放出少量标准液,使尖嘴充满液体,B正确;
C.接近终点时,不需用蒸馏水冲滴定管尖端悬挂的液滴,否则会导致测定结果偏高,C错误;
答案选B;
②由于酸性高锰酸钾溶液显紫红色,则终点的实验现象为当滴入最后一滴KMnO4溶液,锥形瓶中溶液恰好由无色变为浅红色,且半分钟不褪色;n(MnO4-)=V×10-3L×0.0100 mol·L-1,根据方程式可知n(C2O42-)=n(MnO4-)×![]() ×10-5mol,m(C2O42-)=
×10-5mol,m(C2O42-)=![]() ×10-5mol×88 g·mol-1=2.75V×10-2g,所以晶体中所含C2O42-的质量分数为2.75V/100m。
×10-5mol×88 g·mol-1=2.75V×10-2g,所以晶体中所含C2O42-的质量分数为2.75V/100m。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaSO4)=9×10-4,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断中正确的是( )
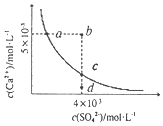
A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液
B.向d点溶液中加入适量CaCl2固体可以变到c点
C.a点对应的Ksp不等于c点对应的Ksp
D.b点将有沉淀生成,平衡后溶液中c(SO42-)=3×10-3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用0.100 mol·L-1盐酸分别滴定20.00 mL 0.100 mol·L-1的NaHA和20.00 mL 0.100 mol·L-1 Na2A溶液,两溶液的pH与所加盐酸体积(V)的关系如图所示。下列说法正确的是( )
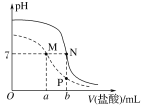
A.HA-的电离常数大于水解常数
B.b=2a
C.M、N点溶液均满足c(Na+)=2c(A2-)+c(HA-)
D.水的电离程度:M=N>P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述正确的是
A.硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B.向Na2SiO3溶液中通入过量的SO2:SiO32-+SO2+H2O=H2SiO3↓+SO32-
C.由Na和C1形成离子键的过程:![]()
D.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在碱的作用下,两分子酯缩合形成β—羰基酯,同时失去一分子醇,该反应称克莱森(R·L·Claisen)酯缩合反应,其反应机理如下:2RCH2COOC2H5![]()
 +C2H5OH。利用Claisen反应制备化合物H的一种合成路线如下:
+C2H5OH。利用Claisen反应制备化合物H的一种合成路线如下:

回答下列问题:
(1)A的名称为__________,C的结构简式为__________。
(2)F中含氧官能团的名称是__________;反应Ⅱ的反应类型是__________。
(3)E→F反应的化学方程式为_________________________________。
(4)B的含有苯环的同分异构体有_____________种(B自身除外),其中核磁共振氢谱显示3组峰的结构简式为__________、__________。
(5)乙酰乙酸乙酯( ![]() )是一种重要的有机合成原料,写出由乙醇制备乙酰乙酸乙酯的合成路线(无机试剂任选)。______________
)是一种重要的有机合成原料,写出由乙醇制备乙酰乙酸乙酯的合成路线(无机试剂任选)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有A+、B3+、C3+ 三种金属阳离子的水溶液发生了如下一系列变化后逐一沉淀出来,其中B3+转入白色沉淀:
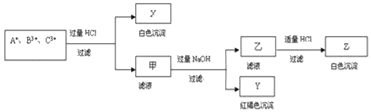
请通过分析回答(用化学符号填写):
(1)A+是__,B3+是__,C3+是__;
(2)X是__,Y是__,Z是__;
(3)写出下列离子方程式:
①生成Y沉淀:__;②B3+与过量氨水反应:__;
(4)写出下列化学方程式:单质铝和Y分解后的固体产物反应:__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5mL 0.005mol/L FeCl3溶液和5mL 0.015mol/L KSCN溶液混合,达到平衡后呈红色。再将混合液分为5份,分别进行如下实验:下列说法不正确的是( )
| 实验①:滴加4滴水,振荡 |
实验②:滴加4滴饱和FeCl3溶液,振荡 | |
实验③:滴加4滴1 mol/L KCl溶液,振荡 | |
实验④:滴加4滴1 mol/L KSCN溶液,振荡 | |
实验⑤:滴加4滴6 mol/L NaOH溶液,振荡 |
A.对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动
B.对比实验①和③,为了证明增加反应物浓度,平衡发生逆向移动
C.对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动
D.对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L 、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示。下列说法正确的是( )
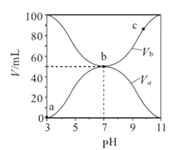
A. Ka(HA)的值与Kb(BOH)的值不相等
B. b点时,水电离出的c(H+)=10-7 mol/L
C. c点时,c(A-)>c(B+)
D. a→c过程中 ![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
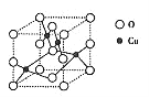
【题目】生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)①上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Cu原子的核外电子排布式:______。
②铜的一种氧化物晶胞中(结构如图所示),所包含的Cu原子数目为______。
③其中O原子的配位数为______。
(2)根据等电子原理,写出CO分子的结构式______。
(3)甲醇催化氧化可得到甲醛(HCHO),甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇沸点比甲醛高得多的原因是______。
②甲醇分子中原子轨道的杂化类型为sp3的原子个数为______。
③甲醛分子的空间构型是______;1mol甲醛分子中σ键的数目为______。
④甲醇中C、H、O三种元素电负性由大到小的顺序为______。
⑤Cu2O的熔点比Cu2S高的原因是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com