
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如下:
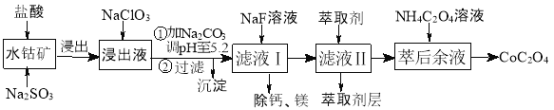
已知①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
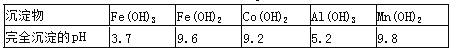
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是_____________。
(2)制取NaClO3可以将氯气通入到热的浓氢氧化钠溶液,该反应的离子方程式为__________________ ;实验需要制取10.65克NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为_______________ (标准状况)。
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。
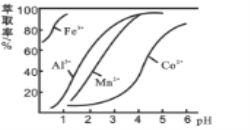
滤液Ⅱ中加入萃取剂的作用是_________;使用萃取剂适宜的pH是______(填选项序号)。
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。
已知K sp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/ c(Ca2+)=________________。
(5)工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离平衡常数K1 =1.8×10-5mol·L-1H2SO4的电离平衡常数K2=1.2×10-2mol·L-1,K3 =1.3×10-8mol·L-1。在通入废气的过程中:
当恰好形成正盐时,溶液中离子浓度的大小关系为____________________________。
【答案】 将Co3+、Fe3+还原 ![]() 6.72L 除去Mn2+ B 0.7
6.72L 除去Mn2+ B 0.7 ![]()
【解析】含钴废料中加入盐酸,可得CoCl3、FeCl3、AlCl3、MnCl2、MgCl2、CaCl2,由信息①中浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等,则加入的Na2SO3将Co3+、Fe3+还原为Co2+、Fe2+。流程最终得到草酸钴,加入NaClO3将Fe2+氧化为Fe3+,加入Na2CO3调pH至5.2,可得到Fe(OH)3 、Al(OH)3 沉淀,过滤后滤液主要含有CoCl2、MnCl2、MgCl2、CaCl2,用NaF溶液除去钙、镁,过滤后,向滤液中加入萃取剂,将锰离子萃取,萃取后的溶液中主要含CoCl2,进入草酸铵溶液得到草酸钴。
(1)浸出过程中加入Na2SO3的目的是将Co3+、Fe3+还原Fe2+ 、Co2+ 。(2)氯气通入热的浓氢氧化钠溶液得到NaClO3,氯化钠与水,离子方程式为:3Cl2+6OH-![]() ClO3-+5Cl-+3H2O,10.65克NaClO3的物质的量为10.65g/106.5g·mol-1=0.1mol,由方程式可知需要氯气物质的量为0.1mol×3=0.3mol,根据电子转移守恒可知,需要的氯气由电解食盐水生成,电解生成氢气与氯气的物质的量相等,氢气体积为0.3mol×22.4L·mol-1=6.72L;(3)滤液中加入萃取剂的作用是除去Mn2+;pH=2与pH=3时Co2+的萃取率变化不大,但pH=3时Mn的萃取率增大很多,而pH=5时,Co2+的萃取率比较大,损失严重,故pH=3.0时最佳,故选B。(4)由溶度积得:c(Mg2+):c(Ca2+)=
ClO3-+5Cl-+3H2O,10.65克NaClO3的物质的量为10.65g/106.5g·mol-1=0.1mol,由方程式可知需要氯气物质的量为0.1mol×3=0.3mol,根据电子转移守恒可知,需要的氯气由电解食盐水生成,电解生成氢气与氯气的物质的量相等,氢气体积为0.3mol×22.4L·mol-1=6.72L;(3)滤液中加入萃取剂的作用是除去Mn2+;pH=2与pH=3时Co2+的萃取率变化不大,但pH=3时Mn的萃取率增大很多,而pH=5时,Co2+的萃取率比较大,损失严重,故pH=3.0时最佳,故选B。(4)由溶度积得:c(Mg2+):c(Ca2+)=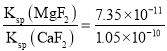 =0.7;(5)NH3·H2O的电离平衡常数K=1.8×10-5mol·L-1,H2SO3的电离平衡常数K2=1.3×10-8mol·L-1,则SO32-的水解程度大于NH4+的水解程度,溶液呈碱性,溶液中氢氧根离子源于水的电离、SO32-的水解,溶液中c(OH-)>c(HSO3-),故溶液中离子浓度大小为:c(NH4+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)。
=0.7;(5)NH3·H2O的电离平衡常数K=1.8×10-5mol·L-1,H2SO3的电离平衡常数K2=1.3×10-8mol·L-1,则SO32-的水解程度大于NH4+的水解程度,溶液呈碱性,溶液中氢氧根离子源于水的电离、SO32-的水解,溶液中c(OH-)>c(HSO3-),故溶液中离子浓度大小为:c(NH4+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)。


科目:高中化学 来源: 题型:
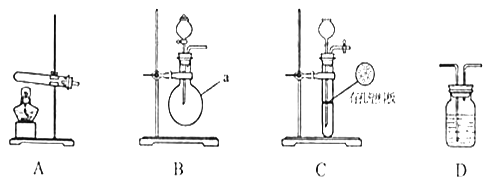
【题目】甲、乙两个研究性学习小组为测定氨分子张氮、氢原子个数比,设计了如下实验流程:

试验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完成后,黑色的氧化铜转化为红色的铜。
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛,有浓硫酸的洗气瓶。
甲小组测得:反应前氧化铜的质量为m1 g、氧化铜反应后剩余固体的质量为m2 g生成氮气在标准状况下的体积V1 L。
乙小组测得:洗气前装置D的质量m3 g、洗气后装置后D的质量m4 g、生成氮气在标准状况下的体积V2 L。
请回答下列问题:
(1)写出仪器a的名称:__________________________________。
(2)检查A装置气密性的操作时___________________________________________。
(3)甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
实验装置 | 实验药品 | 制备原理 | |
甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为______________ |
乙小组 | _____ | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用:_____________________________ |
(4)甲小组用所测数据计算出氨分子中氮、氢的原子个数之比为____________________。
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数比名校小于理论值,其原因是_______________________________ 。为此,乙小组在原有实验的基础上增加了一个装装有药品的实验仪器,重新实验.根据实验前后该药品的质量变化及生成氮气的体积,得出合理的实验结果.该药品的名称是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学应用如图所示装置研究气体的性质.现有某气体,其主要成分是氯气,还含有少量空气和水蒸气,请回答:
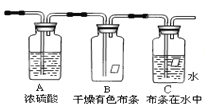
(1)实验室用二氧化锰和浓盐酸制取氯气____________(写化学方程式),该实验研究的主要目的是 。浓硫酸的作用是 。
(2)B、C中能观察到的实验现象是
B中 ;
C中 .
(3)氯水里面含有较多成分,氯水呈黄绿色,起作用的是 ,将紫色石蕊溶液滴入氯水中,氯水显红色,过一会儿,红色消失,起作用的成分是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关活化分子的说法正确的是( )
A. 增大反应物浓度可以提高活化分子百分数
B. 增大体系的压强一定能提高活化分子百分数
C. 使用合适的催化剂可以增大活化分子的能量
D. 升高温度能提高活化分子百分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质的量浓度为cmol/L,则下列关系中不正确的是( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①C(s)+O2(g)==CO2(g)△H= —393.5kJ/mol
②CO(g)+ 1/2 O2(g)== CO2(g)△H= —283.0kJ/mol
③2Fe(s)+3CO(g)==Fe2O3(s)+3C(s) △H= —489.0kJ/mol
则4Fe(s)+3O2(g)==2Fe2O3(s)的反应热ΔH为( )
A.-1641.0kJ/mol B.+3081kJ/mol
C.+663.5kJ/mol D.-2507.0kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学式C8H10O的化合物A具有如下性质;①A+Na![]() 慢慢产生气泡 ②A+RCOOH
慢慢产生气泡 ②A+RCOOH![]() 有香味的产物 ③A
有香味的产物 ③A![]() 苯甲酸 ④其催化脱氢产物不能发生银镜反应 ⑤脱水反应的产物,经聚合反应可制得一种塑料制品(它是目前造成“白色污染”的主要污染源之一)。
苯甲酸 ④其催化脱氢产物不能发生银镜反应 ⑤脱水反应的产物,经聚合反应可制得一种塑料制品(它是目前造成“白色污染”的主要污染源之一)。
试回答;
(1)根据上述信息,对该化合物的结构可作出的判断是_____________;
A.苯环上直接连有羟基 B.苯环侧链末端有甲基
C.肯定有醇羟基 D.肯定是芳香烃
(2)化合物A的结构简式_____________;
(3)A和金属钠反应的化学方程式_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图。反应中镁和铝的 ( )
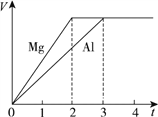
A. 摩尔质量之比为2∶3
B. 物质质量之比为3∶2
C. 物质的量之比为3∶2
D. 物质的量之比为2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中,不正确的是
A. 焰火的五彩缤纷是某些金属元素的性质的展现
B. SiO2可用于制造光导纤维,其性质稳定,不溶于强酸、强碱
C. “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化物有关
D. 根据分散质微粒直径大小可以将分散系分为溶液、胶体和浊液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com