
【题目】NaHCO3 和 NaHSO4 溶液混合后,实际参加反应的离子是( )
A.CO32﹣ 和 H+B.HCO3﹣ 和HSO4﹣
C.CO32﹣ 和HSO4﹣D.HCO3﹣ 和 H+
 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
【题目】下列实验现象所对应的离子方程式不正确的是( )
实 验 | 现 象 | 离子方程式 | |
A |
| 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I﹣+O2═2I2+2H2O |
B |
| 溶液由浅绿色变为红色 | 2Fe2++Cl2═2Fe3++2Cl﹣、 |
C |
| 溶液由黄绿色变为无色 | Cl2+2OH﹣═Cl﹣+ClO﹣+H2O |
D |
| 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH﹣+H++SO |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知海水略呈碱性,钢铁在其中易发生电化腐蚀,有关说法正确的是( )
A.腐蚀时电子从碳转移到铁
B.在钢铁上连接铅块可起到防护作用
C.正极反应为O2+2H2O+4e﹣=4OH﹣
D.钢铁在淡水中易发生析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素X气态氢化物与该元素最高价氧化物的水化物反应生成盐,则该元素( )
A. 在周期表中处于第三周期ⅦA族 B. 在周期表中处于第二周期ⅤA族
C. 氢化物比H2O稳定 D. 常见化合价只有-3、+2、+3、+5价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出C6H6的一种含三键且无支链链烃的结构简式。
②苯不能使溴水因反应而褪色,性质类似烷烃,但能与溴、浓硝酸等发生取代反应,写出苯的硝化反应的化学方程式。
③烷烃中脱去2mol氢原子形成1mol双键要吸热,但1,3-环己二烯( ![]() )脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯(填“稳定”或“不稳定”)。
)脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯(填“稳定”或“不稳定”)。
④1866年凯库勒提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实(填入编号)。
a.苯不能使溴水褪色
b.苯能与H2发生加成反应
c.溴苯没有同分异构体
d.邻二溴苯只有一种
⑤现代化学认为苯分子碳碳之间的键是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学科研小组的同学在精确测试Na2SO3溶液的pH时,遇到了困惑.为此,他们进行了冷静的思考和准备,决心重新实验,揭开奥秘.请你了解情况,参与交流讨论.
[查阅资料]①常温下0.1molL﹣1的H2SO3溶液的pH约为2.1.
②通常情况下,H2S为无色,有腐蛋臭味的气体,其水溶液称为氢硫酸.常温下0.1molL﹣1的H2S溶液的pH约为4.5.
[实验操作]①准确称取纯净的Na2SO37H2O晶体25.20g,配成1L水溶液,测得其pH=7.8.
②以坩埚再次准确称取25.20g上述晶体,继而隔绝空气在600℃以上高温下强热至恒重(只有硫元素的化合价变化成最高价和最低价),质量为12.60g.
③将②所得之12.60g固体进行元素定性定量分析,组成与Na2SO3无异.将其溶于水得250mL溶液,测得pH=10.3.
[分析猜想]Na2SO37H2O在强热下,失去结晶水,进而发生了分解反应(自身氧化还原反应)
[交流讨论]
(1)实验操作②中除坩埚、酒精灯、三角架及隔绝空气的设备外,还需要的仪器有 .
(2)给Na2SO37H2O加热时要隔绝空气,请以简要的文字和化学方程式给以说明. .
(3)猜想Na2SO3在高温强热下发生分解反应的化学方程式是 .
(4)实验①和③中,两次测得的溶液pH相差明显,其合理的解释是 . 实验③中溶液的pH=10.3的原理是(以相关的离子方程式表示) .
(5)请你设计简单的实验方案,给上述分析、猜想及解释以佐证.请简单叙述实验步骤、现象和结论. .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( ) 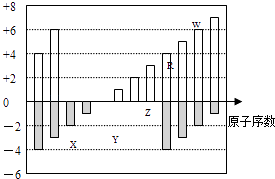
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R>W
C.WX3和水反应形成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.电镀时,通常把待镀的金属制品作阳极
B.氯碱工业是电解熔融的NaCl,在阳极能得到Cl2
C.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为O2+4H++4e-=2H2O
D.工业冶炼金属铝的方法是电解熔融的氯化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图中,甲烧杯中盛有100mL 0.50molL﹣1 AgNO3溶液,乙烧杯中盛有100mL 0.25molL﹣1CuCl2溶液,A,B,C,D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9g,则 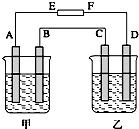
(1)电源E为极,F为极.
(2)A极的电极反应式为 , 析出物质mol.
(3)B极的电极反应式为 , 析出气体mL(标).
(4)C极的电极反应式为 , 析出的物质mol.
(5)D极的电极反应式为 , 析出气体mL(标况).
(6)甲烧杯中滴入石蕊试液,极附近变红,若继续电离,在甲烧杯中最终得到溶液.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com