
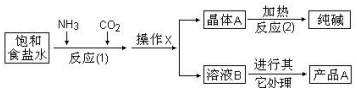
分析 联合制碱法:以食盐、氨和二氧化碳为原料来制取纯碱,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,反应1:CO2+H2O+NaCl+NH3=NaHCO3↓+NH4Cl,经过滤(操作 X )、洗涤得NaHCO3微小晶体(晶体A),再煅烧(反应2)制得纯碱产品,其滤液(溶液B)是含有氯化铵和氯化钠的溶液,从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体,由于氯化铵在常温下的溶解度比氯化钠要大,低温时的溶解度则比氯化钠小,在低温条件下,向滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品.
(1)离子晶体是阴阳离子以离子键结合形成的晶体;由分子构成的物质为分子晶体;由原子构成的物质且以共价键形成空间网状结构的物质为原子晶体;
(2)二氧化碳和水结合生成碳酸,氨气和水结合生成一水合氨,碳酸和一水合氨反应,钠离子和碳酸氢根离子结合生成碳酸氢钠沉淀;
(3)固液分离的方法为过滤;
(4)经过滤(操作 X )、洗涤得NaHCO3微小晶体(晶体A),其滤液(溶液B)是含有氯化铵和氯化钠的溶液,通入 NH3,增大NH4+ 的浓度,使 NH4Cl 更多地析出,使 NaHCO3 转化为溶解度更大的Na2CO3,提高析出的NH4Cl;
(5)通过称量沉淀碳酸钡的质量,根据原子守恒来计算样品中纯碱的质量分数,需洗涤沉淀,除去杂质离子,且需干燥,恒重,样品中纯碱的质量分数,根据碳守恒计算.
解答 解:(1)纯碱是碳酸钠的俗称,是由钠离子和碳酸根离子构成的盐,钠离子、碳酸根离子间存在离子键,属于离子晶体,原子电子层数越多,其原子半径越大,钠原子核外三层电子,碳、氧原子两层电子,所以原子的半径从大到小依次为:Na>C、O,同一周期元素,原子半径随着原子序数增大而减小,所以C>O,所以元素原子的半径从大到小依次为Na>C>O,
故答案为:离子;Na>C>O;
(2)以食盐、氨和二氧化碳为原料来制取纯碱,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,碳酸氢钠的溶解度比碳酸钠小,所以发生NH3+CO2+H2O═NH4HCO3;NH4HCO3+NaCl═NaHCO3↓+NH4Cl,即反应1:CO2+H2O+NaCl+NH3=NaHCO3↓+NH4Cl,
故答案为:CO2+H2O+NaCl+NH3=NaHCO3↓+NH4Cl;
(3)反应1:CO2+H2O+NaCl+NH3=NaHCO3↓+NH4Cl,从溶液中分离出固体,采用过滤的方法,
故答案为:过滤;
(4)经过滤(操作 X )、洗涤得NaHCO3微小晶体(晶体A),从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体,由于氯化铵在常温下的溶解度比氯化钠要大,低温时的溶解度则比氯化钠小,在低温条件下,通入氨气,增大NH4+ 的浓度,可以使氯化铵单独结晶沉淀析出,并向滤液中加入细粉状的氯化钠,使 NaHCO3 转化为溶解度更大的 Na2CO3,提高析出的NH4Cl,经过滤、洗涤和干燥即得氯化铵产品,
故答案为:增大NH4+ 的浓度,使NH4Cl 更多地析出;使 NaHCO3 转化为溶解度更大的Na2CO3,提高析出的NH4Cl;
(5)加入足量的 BaCl2溶液:发生反应:Na2CO3+BaCl2=BaCO3↓+2NaCl,Na2CO3~BaCO3,根据原子守恒,通过称量沉淀碳酸钡的质量,来计算样品中纯碱的质量分数,需洗涤沉淀,除去杂质离子,且将沉淀冷却到室温,恒重操作后最终得到固体 b(g)为BaCO3,根据碳守恒,纯碱的质量分数=$\frac{106b}{197a}$×100%,
故答案为:洗涤;冷却;恒重操作; $\frac{106b}{197a}$.
点评 本题考查了联合制碱法,明确碳酸钠、碳酸氢钠、氨气、氯化铵的性质,掌握工艺流程和反应原理是解题关键,题目难度中等.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | w=$\frac{36.5a}{(36.5a+22400)}$ | B. | w=$\frac{36.5c}{1000b}$ | ||
| C. | C=$\frac{1000ab}{(36.5a+22400)}$ | D. | b=$\frac{(36.5a+22400)}{(a+1)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高铁酸钾(K2FeO4)是一种新型高效、多功能水处理剂,既能杀菌消毒又能净水 | |
| B. | “光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关 | |
| C. | 用SO2漂白纸浆和草帽辫,该过程利用了SO2的氧化性 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯分子有7个σ键,1个π键 | |
| B. | 丙烯分子中3个碳原子都是sp2杂化 | |
| C. | 丙烯分子中最多有7个原子共平面 | |
| D. | 丙烯分子中3个碳原子在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
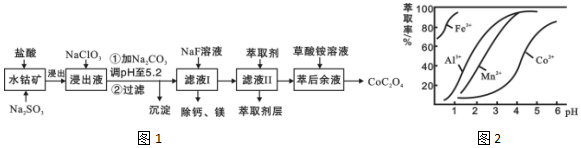
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
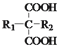 $\stackrel{△}{→}$
$\stackrel{△}{→}$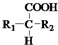 +CO2↑(R1和R2代表烷基)
+CO2↑(R1和R2代表烷基)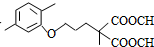 $\stackrel{△}{→}$
$\stackrel{△}{→}$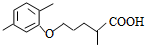 +CO2↑.
+CO2↑.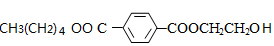 ,则X与Y发生缩聚反应所得缩聚物的结构简式是
,则X与Y发生缩聚反应所得缩聚物的结构简式是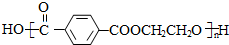 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.下列说法正确的是( )
向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.下列说法正确的是( )| A. | 开始时产生的气体为H2 | |
| B. | AB段发生的反应为置换反应 | |
| C. | 所用混合溶液中c(HNO3)=0.5 mol•L-1 | |
| D. | 参加反应铁粉的总质量m2=5.6 g |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .用电子式表示D2C的形成过程
.用电子式表示D2C的形成过程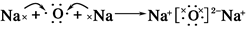 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com