
(15分)为测定某 样品(含少量
样品(含少量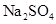 杂质)的纯度,实验室按以下步骤进行:①
称取
杂质)的纯度,实验室按以下步骤进行:①
称取
 样品,置于烧杯中;
样品,置于烧杯中;
②加入适量蒸馏水,使样品溶解,然后配制成250mL溶液;
③准确量取25.00mL步骤②中配得的溶液;
然后,可采用下列两种方法进行测定:
|
方法一 |
方法二 |
|
④将25.00mL溶液置于烧杯中,加入过量的稀盐酸充分搅拌; ⑤加入过量 ⑥过滤、洗涤、干燥沉淀、称量得到bg固体。 |
④将25.00mL溶液置于锥形瓶中; ⑤用0.1 mol |

请根据上述实验,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用的的仪器是E和_______(填字母);
(2)在方法一④中加入过量稀盐酸的目的是____________________________________;
(3)在方法一测定得到 样品的纯度是______________(列出算式,可不化简);
样品的纯度是______________(列出算式,可不化简);
(4)在方法二中,是否需要加入指示剂________(填“是”或“否”),请简述理由___
__________________________________________________________________;
(5)在方法二中达到滴定终点读取数据时,俯视液面,则测定结果___________________(填“偏高”、“偏低”、“无影响”)。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

已知Fe3+、Cu2+、Fe2+三种离子在溶液中形成氢氧化物沉淀的pH范围如下图所示:

请回答下列问题:
(1)在整个实验过程中,下列实验装置不可能用到的是_________(填序号)。

(2)溶液A中所含溶质的化学式为____________________________________。
(3)物质X应选用___________________________(填字母)。
A.氢氧化钠 B.双氧水 C.铁粉 D.高锰酸钾
(4)沉淀Ⅱ的化学式为____________________,步骤③中加入适量Cu(OH)2将pH调至4.0的目的是________________________________________。
(5)样品中CuO质量分数为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)为测定某![]() 样品(含少量
样品(含少量![]() 杂质)的纯度,实验室按以下步骤进行:①称取
杂质)的纯度,实验室按以下步骤进行:①称取![]()
 样品,置于烧杯中;
样品,置于烧杯中;
②加入适量蒸馏水,使样品溶解,然后配制成250mL溶液;
③准确量取25.00mL步骤②中配得的溶液;
然后,可采用下列两种方法进行测定:
| 方法一 | 方法二 |
| ④将25.00mL溶液置于烧杯中,加入过量的稀盐酸充分搅拌; ⑤加入过量 ⑥过滤、洗涤、干燥沉淀、称量得到bg固体。 | ④将25.00mL溶液置于锥形瓶中; ⑤用0.1 mol |
请根据上述实验,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用的的仪器是E和_______(填字母);
(2)在方法一④中加入过量稀盐酸的目的是____________________________________;
(3)在方法一测定得到![]() 样品的纯度是______________(列出算式,可不化简);
样品的纯度是______________(列出算式,可不化简);
(4)在方法二中,是否需要加入指示剂________(填“是”或“否”),请简述理由___
__________________________________________________________________;
(5)在方法二中达到滴定终点读取数据时,俯视液面,则测定结果___________________(填“偏高”、“偏低”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
为测定某![]() 样品(含少量
样品(含少量![]() 杂质)的纯度,实验室按以下步骤进行:① 称取
杂质)的纯度,实验室按以下步骤进行:① 称取![]()
![]() 样品,置于烧杯中;
样品,置于烧杯中;
②加入适量蒸馏水,使样品溶解,然后配制成250mL溶液;
③准确量取25.00mL步骤②中配得的溶液;
然后,可采用下列两种方法进行测定:
| 方法一 | 方法二 |
| ④将25.00mL溶液置于烧杯中,加入过量的稀盐酸充分搅拌; ⑤加入过量 ⑥过滤、洗涤、干燥沉淀、称量得到bg固体。 | ④将25.00mL溶液置于锥形瓶中; ⑤用0.1 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com