
(分)(1)在硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行 次。
(2)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、 、 。
(3)下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体)。

请回答下列问题:
①能用作干燥氨气的装置有_______________(填字母);
②既能用于收集氯气又能用于收集一氧化氮气体的装置有_______________(填字母);
③在实验室制备氯气的实验中,用以除去氯气中氯化氢等杂质气体的装置有________________ (填字母);
④能用于乙烯与溴水反应制二溴乙烷的实验装置有___________________(填字母);
⑤在C装置中,若用烧杯内的氢氧化钠溶液吸收尾气二氧化硫,则广口瓶的作用是___________________。
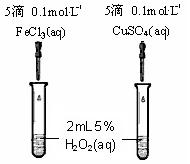 (4)为比较Fe3+和Cu2+对H2O2分解的催化效果,某同学设计了右图所示的实验。
(4)为比较Fe3+和Cu2+对H2O2分解的催化效果,某同学设计了右图所示的实验。
①可通过观察 来定性的得出结论;
②有A同学提出将CuSO4改为CuCl2更为合理,其理是 ;
若不采用A同学的改进方案,你认为还可以如何改 进? 。
(1)4 (1分)
(2)环形玻璃搅拌棒(不答环形不得分)、量筒 (2分)
(3) ① DE (2分)
②AB (2分)
③A (1分)
④A (1分)
⑤防止倒吸 (1分)
(4)①反应产生气泡快慢或反应完成的先后或试管壁的冷热程度。(1分,答出一种情况即可)
②使阴离子相同,排除阴离子的干扰;将FeCl3改为Fe2(SO4)3 。 (2分)
本题考查化学实验基本知识及简单实验方案设计;(1)测定硫酸铜晶体中结晶水含量,一准确称量干燥的坩埚的质量,二用此坩埚准确称取一定质量已研碎的硫酸铜晶体,三在反应完毕在干燥器内冷却后称量坩埚和无水硫酸铜的质量,四再加热变,称量,两次称量的质量相差不超过0.1g,共需称量4次;(2)中和热反应中用的玻璃仪器还有:环形玻璃搅拌棒、量筒 ;(3)氨气常用碱石灰做干燥剂,可选用装置DE;氯气和NO都有毒,密度比空气大,氯气可溶于水,NO难溶于水,可用向上排气法和排水法收集,采用装置AB; 实验室制备氯气常混有氯化氢和水蒸气常用装置A除杂;乙烯与溴水在常温下可发生加成反应,可采用装置A;由于SO2易与溶于氢氧化钠溶液,所以在尾气吸收装置中连接一广口瓶,为了防止倒吸;(4)Fe3+和Cu2+对H2O2分解的催化效果可通过观察反应产生气泡的快慢可反应完成的先后,或试管壁的冷热程度来得出结论;将CuSO4改为CuCl2,使阴离子相同,排除阴离子的干扰;还可以将FeCl3改为Fe2(SO4)3 ,使实验达到更理想的效果。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 2NH3(g),在一定条件下,向VL密闭容器中加入xmolN2,ymol H2进行反应,经过2min后测得NH3zmol,用N2、H2、NH3表示的反应速率分别是:
2NH3(g),在一定条件下,向VL密闭容器中加入xmolN2,ymol H2进行反应,经过2min后测得NH3zmol,用N2、H2、NH3表示的反应速率分别是:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)
Ⅰ. 砷化镓为第三代半导体,以其为材料制造的灯泡寿命长.耗能少。已知砷化镓的晶胞结构如图所示。请回答下列问题:
(1)下列说法正确的是__________(填序号)
A.砷化镓晶胞结构与NaCl相同 B.第一电离能 As>Ga
C.电负性 As>Ga D.原子半径 As>Ga
(2)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为__________;
(3)AsH3空间形状为___________;已知(CH3)3 Ga为非极性分子,则其中镓原子的杂化方式为____________;
Ⅱ. 金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(4)请解释金属铜能导电的原因 , Cu2+的核外电子排布式为__________________________。
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有 和 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年辽宁省高三第四次模拟考试(理综)化学部分 题型:填空题
(13 分)
(1)CuSO4溶液是中学化学及工农业生产中常见的一种试剂。某同学利用CuSO4溶液,进行以下实验探究。
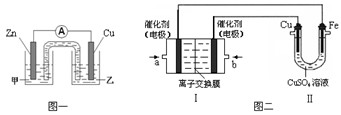
① 图一是根据反应Zn + CuSO4 = Cu + ZnSO4 设计成的锌铜原电池。电解质甲溶液是 (填“ZnSO4”或“CuSO4”)溶液;Cu极的电极反应式是 。
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是 (填“CH4”或“O2”),a处电极上发生的电极反应式是 。
(2)将蓝矾(CuSO4·5H2O)、生石灰和水按一定比例混合,即可得到波尔多液(杀菌剂),其 有效成分为难溶的碱式硫酸铜[xCuSO4 ·yCu(OH)2]。为测定某碱式硫酸铜的组成进行了如下实验:取等质量的碱式硫酸铜样品两份,一份滴加稀盐酸至恰好完全溶解,另一份高温灼烧后只得到CuO固体。所得数据显示n(HCl)︰n(CuO)=3︰2,则该碱式硫酸铜的化学式中x︰y= 。
(3)E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:
xM(g) Mx
(g),反应物和生成物的物质的量随时间的变化关系如下图。下 列说法正确的是
Mx
(g),反应物和生成物的物质的量随时间的变化关系如下图。下 列说法正确的是
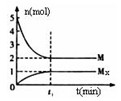
B.平衡时混合气体的平均摩尔质量是33.3
C.t1时刻,保持温度不变,再充入1molM,重新达到平衡时, 将增大
将增大
D.M的沸点比同主族下一周期元素的气态氢化物沸点低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com