
| A. | 把氯气通入FeCl2溶液中 | |
| B. | 把绿豆大的钾投入水中 | |
| C. | 把溴水滴加到KI淀粉溶液中 | |
| D. | 把一段打磨过的镁带放入少量冷水中 |
 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na<Mg | B. | 热稳定性:HCl>H2S | ||
| C. | 酸性强弱:H2SiO3<H2CO3 | D. | 碱性强弱:NaOH>Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 只有非金属原子间才能形成共价键 | |
| C. | 由共价键形成的一定是共价化合物分子 | |
| D. | 熔化后不导电的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能与水反应 | B. | 能与硫酸反应 | ||
| C. | 不能与氢氧化钠反应 | D. | 能与碳酸钠反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
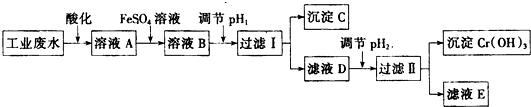
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com