
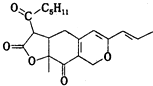
| A. | 红曲素含有两种含氧官能团 | |
| B. | 红曲素分子式为C21H25O5 | |
| C. | 红曲素能使酸性高锰酸钾溶液褪色 | |
| D. | lmol红曲素最多能与2 mol NaOH反应 |
科目:高中化学 来源: 题型:选择题
| A. | 充电时阳极反应为Zn-2e-+2OH-═Zn(OH)2 | |
| B. | 充电时OH-向阳极移动 | |
| C. | 放电时每转移3mole-正极有1molK2FeO4被氧化 | |
| D. | 充电时,电源的正极应与电池的Zn(OH)2极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
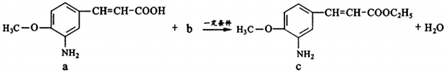
| A. | a中参加反应的官能团是羧基 | B. | 生活中b可作燃料和溶剂 | ||
| C. | c极易溶于水 | D. | 该反应类型为取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

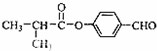 ;
;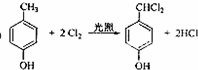 ;
;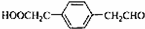 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中CuO和C高温反应的气体产物: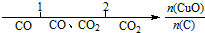 | |
| B. | Na2O2和等物质的量的CO2、H2O(g):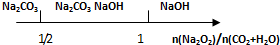 | |
| C. | NaOH溶液中通入一定量的CO2的产物: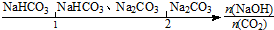 | |
| D. | AlCl3溶液中滴加NaOH溶液后体系中铝元素的存在形式: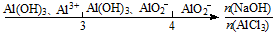 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6kJ•mol-1
(1)已知H-H 键能为436kJ•mol-1,H-N键键能为391kJ•mol-1,根据化学方程式:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1.则N≡N键的键能是945.6kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O | B. | NO2 | C. | N2O4 | D. | NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1KNO3溶液:H+、Fe2+、SCN-、SO42- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的溶液:S2-、NO3-、Cl-、Na+ | |
| C. | 0.1 mol•L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | |
| D. | 由水电离出来的c(H+)=10-10mol•L-1的溶液:Na+、SO42-、S2-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com