
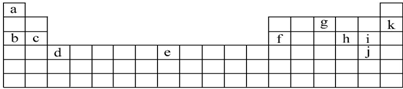
分析 由元素在周期表的位置可知,a为H,b为Na,c为Mg,f为Al,g为N,k为Ne,h为S,i为Cl,j为Br,d为Sc,e为Fe,
(1)位于第ⅤⅡA元素(或第17列)的为卤族元素;
(2)位于第18列的为稀有气体元素;
(3)位于第1列的为碱金属元素,H除外;
(4)g元素的最高价氧化物对应的水化物的稀溶液,为稀硝酸,与过量Fe反应生成硝酸亚铁、NO和水.
解答 解:由元素在周期表的位置可知,a为H,b为Na,c为Mg,f为Al,g为N,k为Ne,h为S,i为Cl,j为Br,d为Sc,e为Fe,
(1)属于卤族元素的有Cl、Br,故答案为:Cl、Br;
(2)属于稀有气体元素的有Ne,故答案为:Ne;
(3)属于碱金属元素的有Na,故答案为:Na;
(4)g元素的最高价氧化物对应的水化物的稀溶液,为稀硝酸,与过量Fe反应生成硝酸亚铁、NO和水,离子反应为3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,
故答案为:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素化合物知识等为解答的关键,侧重分析与应用能力的考查,注意元素的位置及族的名称,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
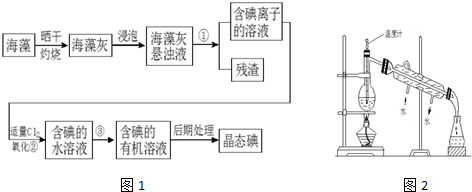
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.89 | |
| 主 要 化 合 价 | 最高价 | +2 | +1 | +5 | +7 | +1 | +5 | +2 | |
| 最低价 | -2 | -3 | -1 | -3 | |||||
| A. | ③和⑥、④和⑦分别处于同一主族 | |
| B. | 元素④处于第3周期ⅤA族 | |
| C. | 元素⑥对应的氢氧化物是强碱 | |
| D. | 元素①与元素⑥形成的化合物中不可能存在共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
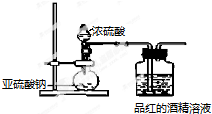
| 同浓度溶液 | SO${\;}_{3}^{2-}$ | HSO${\;}_{3}^{-}$ | H2SO3 | 褪色速度 |
| Na2SO3溶液 | 多 | 少 | 少 | 快 |
| NaHSO3溶液 | 较上面少 | 较上面多 | 较上面多 | 慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
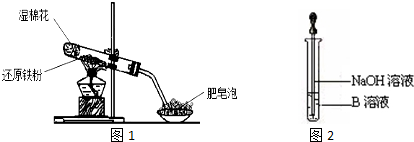
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,反应类型取代反应
,反应类型取代反应查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com