
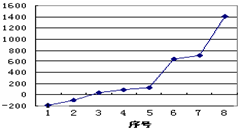
 (1)第三周期8种元素按单质熔点高低的顺序
(1)第三周期8种元素按单质熔点高低的顺序
| ||
| 2 |
| 2 |
| 2 |
| 2 |
| m |
| V |
| 1 |
| 8 |
| 1 |
| 2 |
| ||
| 2 |
| 2 |
| 2 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| M |
| NA |
| ||
16
|
| M | ||
4
|
| M | ||
4
|


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
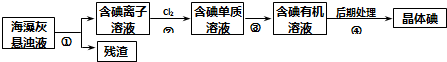
| A、步骤④的操作是过滤 |
| B、可用淀粉溶液检验步骤②的反应是否进行完全 |
| C、步骤①、③的操作分别是过滤、萃取 |
| D、步骤③中加入的有机溶剂可能是苯或CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 据以上线索和下列反应事实,
据以上线索和下列反应事实,

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com