
【题目】根据下列化合物:①CH3COOH ②Na2C2O4③NaCl ④NaOH⑤NH4Cl.回答问题:
(1)H2C2O4是弱酸,则②溶液中盐水解的离子方程式为;
(2)浓度均为 0.1molL﹣1 的④、⑤溶液等体积混合后,c(Na+)+c(NH4+)+c(NH3H2O)=;
(3)常温下,pH都为4的①、⑤溶液中水电离出的c(OH﹣)的比为 .
【答案】
(1)C2O42﹣+H2O?HC2O4﹣+OH﹣,HC2O4﹣+H2O?H2C2O4+OH﹣
(2)0.1mol/L
(3)1×10﹣6
【解析】解:(1)草酸根离子分步水解,水解可逆,离子方程式为C2O42﹣+H2OHC2O4﹣+OH﹣,HC2O4﹣+H2OH2C2O4+OH﹣,
故答案为:C2O42﹣+H2OHC2O4﹣+OH﹣,HC2O4﹣+H2OH2C2O4+OH﹣;(2)据物料守恒,c(NH4+)+c(NH3H2O)= ![]() ×0.1mol/L,c(Na+)=
×0.1mol/L,c(Na+)= ![]() ×0.1mol/L,所以c(Na+)+c(NH4+)+c(NH3H2O)=0.1mol/L,
×0.1mol/L,所以c(Na+)+c(NH4+)+c(NH3H2O)=0.1mol/L,
故答案为:0.1mol/L;(3)pH为4的CH3COOH抑制水的电离,水电离出的c(OH﹣)=10﹣10mol/L,pH=4的NH4Cl促进是因为铵根水解促进水的电离,水电离出的c(OH﹣)=10﹣4mol/L,水电离出的c(OH﹣)的比为 ![]() =1×10﹣6,故答案为:1×10﹣6.
=1×10﹣6,故答案为:1×10﹣6.
(1)草酸是2元弱酸,草酸根离子分步水解;(2)NaOH溶液和NH4Cl溶液等物质的量反应生成NaCl和NH3H2O,据物料守恒分析;(3)CH3COOH抑制水的电离,NH4Cl促进水的电离.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组元素性质的递变情况错误的是 ( )
A. Li、Be、B原子最外层电子数依次增多
B. P、S、Cl元素最高正价依次升高
C. N、O、F电负性依次增大
D. Na、K、Rb第一电离能逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锰(MnCO3)是高性能磁性材料,金属钨是重要的战略物资。由黑钨矿(主要成分为FeWO4、MnWO4,少量SiO2)制取碳酸锰和金属钨的流程如下:

已知:①钨酸(H2WO4)酸性很弱,难溶于水,其钠盐易溶于水。②SiO32-和WO42-完全沉淀的pH分别为8、5。③草酸(H2C2O4)具有酸性和还原性,能分解。
回答下列问题:
(1)将矿石粉碎的目的是_____________________。
(2)固体(X)的化学式是____________________________。
(3)写出高温焙烧过程中,MnWO4发生反应的化学方程式________________。
(4)MnO2与硫酸、草酸反应的离子方程式是__________________________。测得一定量MnO2完全溶解的时间与温度的关系如图所示,分析控温加热75℃时MnO2溶解所需时间最少的原因__________________。

(5)滤液Ⅱ调节pH应选择的试剂为_________________。
A.WO3 B.氨水 C.稀盐酸 D.NaHCO3
(6)用Na2CO3溶液沉淀Mn2+时,应控制MnSO4溶液的pH不超过8,防止生成Mn(OH)2,用Na2CO3溶液沉锰采取的操作方法是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是
A. 钠与水反应的离子方程式:2Na+2H2O==2Na++2OH-+H2↑
B. 用惰性电极电解硝酸银溶液的离子方程式:4Ag++2H2O![]() 4Ag+O2↑+4H+
4Ag+O2↑+4H+
C. 电解精炼铜的阴极反应式:Cu2++2e-=Cu
D. 苯乙烯聚合反应的化学方程式: 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NOx、SO2、CO等大气污染气体的处理具有重要意义.
(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S.已知:1molCO(g)与适量的SO2(g)反应生成S(s)和CO2(g)时,放出135kJ的热量,则此反应的热化学方程式为.
(2)用CH4催化还原NOx也可以消除氮氧化物的污染.例如: ①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=﹣574kJ/mol
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2
若1molCH4(g)直接将NO2(g)还原至N2(g),整个过程中放出的热量为867kJ,则△H2= .
(3)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可转化为N2(g)和CO2(g)得到净化.已知 2NO(g)+2CO(g)N2(g)+2CO2(g)△H<0 在25℃、101kPa下,将2molNO、2.4molCO通入固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如图所示.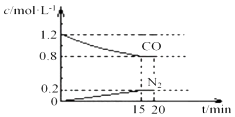
①0~15min 内,v(CO2)= , 25℃时该反应平衡常数为(该空保留2位小数);
②20min 时若改变反应条件,导致NO浓度下降,则改变的条件不可能是(填选项序号).
a.升高温度 b.增加CO的量 c.降低温度 d.扩大容积
(4)SO2尾气常用饱和Na2SO3溶液吸收,减少SO2气体污染并可得到重要的化工原料NaHSO3 . 已知NaHSO3溶液同时存在以下两种平衡: ①HSO3﹣SO32﹣+H+ , ②HSO3﹣+H2OH2SO3+OH﹣;常温下,0.1 mol/L NaHSO3溶液的pH<7,则该溶液中c(H2SO3)c(SO32﹣)(填“>”、“=”或“<”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
2Zn(s)+O2(g)=2ZnO(s) △H1
4Ag(s)+O2(g)=2Ag2O(S) △H2
则Zn(s)+Ag2O(s)=2Ag(s)+ZnO(s),△H值为
A. △H2-△H1 B. △H2+△H1 C. ![]() (△H1-△H2) D.
(△H1-△H2) D. ![]() (△H2-△H1)
(△H2-△H1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用来判断非金属性强弱依据的是
A. 单质的熔点、沸点高低
B. 非金属之间发生的置换反应
C. 非金属与氢气生成气态氢化物的难易程度
D. 非金属元素的最高价氧化物的水化物的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池的装置如图所示,看到b极上有红色金属析出,回答下列问题:

①若a、b是两种活动性不同的金属,则活动性a____b(填>、<或=);
②电路中的电子从____经导线流向_____(填a或b);
③溶液中的SO42-向________极移动(填a或b);
④若两电极分别是Al和C,则负极的电极反应式为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com