
| A. | 联碱法对母液的处理方法是向母液中通入二氧化碳,冰冻和加食盐 | |
| B. | 列管式热交换器的使用实现了原料的充分利用 | |
| C. | 焙烧辰砂制取汞的反应原理为:HgS+O2$\stackrel{焙烧}{→}$Hg+SO2 | |
| D. | 氯碱工业、铝的冶炼、牺牲阳极的阴极保护法都是应用了电解池的原理 |
分析 A.依据联碱法对母液处理方法解答;
B.热交换器充分利用的是能量;
C.依据硫化汞与氧气反应生成二氧化硫和汞的性质解答;
D.依据牺牲阳极的阴极保护法是应用原电池工作原理解答.
解答 解:A.联碱法对母液处理方法:向母液中通入氨气,冰冻和加食盐,故A错误;
B.列管式热交换器的使用能量在流程中的充分利用,降低了能耗,故B错误;
C.硫化汞与氧气反应生成二氧化硫和汞,可以用焙烧辰砂制取汞,故C正确;
D.牺牲阳极的阴极保护法应用的是原电池工作原理,故D错误;
故选:C.
点评 本题为综合题,考查了联碱法原理、列管式热交换器作用、焙烧辰砂制取汞的反应原理、氯碱工业、电解质法制备铝、金属的腐蚀与防护,明确工艺流程及反应原理,熟悉电解质、原电池工作原理是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
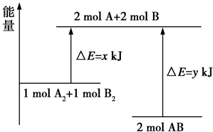
| A. | 该反应过程吸收能量 | |
| B. | 断裂 1molA-A 键和 1molB-B 键可放出 x kJ 能量 | |
| C. | 形成 2molA-B 键需要放出 y kJ 能量 | |
| D. | 2molAB 的总能量高于 1molA2和 1molB2的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 ;元素⑩名称为溴在周期表中的位置第四周期ⅤⅡA族.
;元素⑩名称为溴在周期表中的位置第四周期ⅤⅡA族.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ③CH3CH2Cl ④CH3COOH ⑤聚乙烯五种物质中:
③CH3CH2Cl ④CH3COOH ⑤聚乙烯五种物质中:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | “臭氧空洞”“温室效应”“光化学烟雾”“硝酸型酸雨”的形成过程都与氮氧化合物有关 | |
| B. | 石油裂解、煤的气化、海水制镁、石油中提取石蜡等过程中都包含化学变化 | |
| C. | 低碳经济就是以低耗能、低污染、低排放为基础的经济发展模式 | |
| D. | 可利用丁达尔效应鉴别氢氧化铁胶体和氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝制餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物 | |
| B. | 发酵粉中含有的碳酸氢钠,能使焙制出的糕点疏松多孔 | |
| C. | Na2O2既可作呼吸面具中O2的来源,又可漂白织物、麦杆、羽毛等 | |
| D. | 明矾能水解生成Al(OH)3胶体,常用作生活用水的消毒剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com