
| ||
 2PbSO4+2H2O:
2PbSO4+2H2O:
| ||
| 叶绿体 |
| ||


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:









查看答案和解析>>
科目:高中化学 来源: 题型:
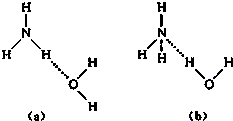 完成下列各题
完成下列各题 NH4++OH-,试判断NH3溶于水后,形成NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成NH3?H2O的合理结构是查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | 丙 |
| 甲烷(乙烯) | ||
| 乙醇(水) |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) ![]() CH3OH(g)。根据题意完成下列各题:
CH3OH(g)。根据题意完成下列各题:

(1) 判断该反应达到平衡状态的标志是 。(填字母)
a.CO和CH3OH浓度相等
b.CO百分含量保持不变
c.容器中气体的压强不变
d.CH3OH的生成速率与CO的消耗速率相等
e.容器中混合气体的密度保持不变
(2) 欲提高CO的转化率,下列措施可行的是
。(填字母)
a.向装置中再充入N2 b.向装置中再充入H2
c.改变反应的催化剂 d.升高温度
(3) 反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(4) 在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(5) 在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com