
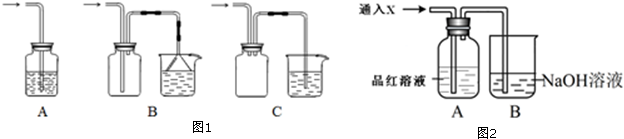
分析 (1)极易溶于水的气体,若吸收时导管伸入水中,由于气体溶于水,导致装置内压强急剧降低,外界大气压压着液体进入,产生倒吸现象;
(2)能使品红褪色的气体往往具有漂白性,常见由二氧化硫、臭氧等,二氧化硫的漂白具有不稳定性.
解答 解:(1)A.吸收装置中的导管没直接伸入到液体中,不易吸收气体,故A错误;
B.吸收装置中的导管下联漏斗,漏斗口与液面相平,可吸收易溶性气体,能防止倒吸,故B正确;
C.即使倒吸,也是吸入到集气瓶中,不会进入反应器中,能防止倒吸,故C正确;
故答案为:BC;
(2)能使品红褪色的气体有SO2、Cl2 (O3、ClO2等),二氧化硫的漂白具有不稳定性,将褪色后的溶液再加热,如果溶液又恢复成红色,则X一定为SO2.
故答案为:SO2、Cl2 (O3、ClO2等);将褪色后的溶液再加热,如果溶液又恢复成红色,则X一定为SO2.
点评 本题考查了物质制备方案设计以及二氧化硫的性质,主要考查尾气吸收装置等,题目难度中等,侧重于基础知识的综合应用的考查,注意对基础知识的积累.


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R的最高价氧化物对应的水化物的酸性比X的弱 | |
| B. | 非金属性:Y>X | |
| C. | 原子半径的大小顺序:X>Z | |
| D. | Z元素最高价氧化物对应的水化物具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.4g二氧化碳中含有的共用电子对数为0.4NA | |
| B. | 用二氧化硅制取单质硅时,当生成2.24 L气体(标准状况)时,得到2.8 g硅 | |
| C. | 标准状况下,0.5NA 个NO和0.5NA 个O2混合气体的体积约为22.4 L | |
| D. | 常温时0.1 mol•L-1 硝酸铵溶液中,NH4+和H+总数一定大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
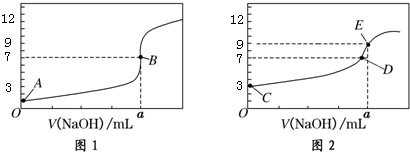
| A. | 图1是滴定CH3COOH 溶液的曲线 | |
| B. | 图2若用甲基橙作指示剂达到滴定终点时,则溶液由黄色变为红色 | |
| C. | 点D所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 如果C、E两点对应的pH分别为3、9,则水电离的氢离子浓度之比为1:100 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
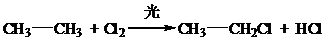 、取代反应
、取代反应 、取代反应.
、取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个N≡N键断裂的同时,有3个H-H键形成 | |
| B. | 1个N≡N键断裂的同时,有3个H-H键断裂 | |
| C. | N2、H2、NH3的分子数之比为1:3:2 | |
| D. | 1个N≡N键断裂的同时,有6个H-N键形成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com