
下列溶液中可能含有SO![]() 、SO
、SO![]() 、S2-、Cl-、Br-、I-、NO
、S2-、Cl-、Br-、I-、NO![]() 、Na+、Mg2+等离子.
、Na+、Mg2+等离子.
(1)滴入溴水后,溶液由无色变为棕黄色,并出现浑浊,则溶液中一定含有_______。
(2)若加氯化钡溶液及盐酸的混合溶液无沉淀生成.若先加入氯水,然后再加入氯化钡溶液和盐酸,有白色沉淀生成,则原溶液中一定含有_____________________。
(3)若加入氢氧化钡溶液无沉淀生成,加入硝酸银溶液也无沉淀生成,则原溶液中阴、阳离子只可能是_____________________________。
科目:高中化学 来源: 题型:阅读理解
| 试样 | 所加试剂 | 实验现象 |
| 第一份试液 | 滴加适量的淀粉KI溶液 | 呈蓝色 |
| 第二份试液 | 滴加用盐酸盐化的BaCl2溶液 | 有白色沉淀 |
| 第三份试液 | 滴加溶液,加热,加入的氢氧化钠溶液体积(V)与生成的沉淀、产生的气体关系(n)如右图. |  |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO2)/mol?L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(SO2)/mol?L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2012?闸北区二模)某同学在研究前l8号元素时发现,可以将它们按原子序数递增的顺序排成如右图所示的“蜗牛”形状,图中每个“?”代表一种元素,其中O点代表氢元素.
(2012?闸北区二模)某同学在研究前l8号元素时发现,可以将它们按原子序数递增的顺序排成如右图所示的“蜗牛”形状,图中每个“?”代表一种元素,其中O点代表氢元素.| 共价键 | H-F | H-Cl | H-Br | H-O | H-S | H-N | H-P |
| 键长(pm) | 92 | 127 | 141 | 98 | 135 | 101 | 321 |
| 键能(kJ/mol) | 568 | 432 | 368 | 464 | 364 | 391 | 142 |
查看答案和解析>>
科目:高中化学 来源: 题型:
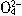 、H2SO3、
、H2SO3、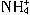 )分别进行如下实验:
)分别进行如下实验: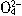 C.H2SO3 D.
C.H2SO3 D.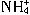
查看答案和解析>>
科目:高中化学 来源:河北省模拟题 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com