
���� X��Y��Z��W��HΪԭ������������������ֶ�����Ԫ�أ�Z��Y���ڣ�Z��WҲ���ڣ� Y��Z��W����Ԫ�ص�ԭ������������֮��Ϊ17����Y��Z��W���ߴ���ͬһ���ڻ�ͬһ���壬����������֮�Ͳ�����Ϊ17�����ڲ�ͬ���ڵ�Y��Z��W�������ڣ����ܳ��ֵ�λ�ù�ϵ�У�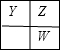
 ����Y������������Ϊx����Ϊ��һ�����������x+x+1+x+1=17�����x=5��Y��Z��W��Ӧ������Ԫ�طֱ�ΪN��O��S����Ϊ�ڶ������������x+x+x+1=17��xΪ������������������Y��NԪ�أ�X��Y��Z��W�����һ�������ԭ�Ӹ���֮��Ϊ8��2��4��1������������ԭ������ԭ�Ӹ���֮��Ϊ1��4��Ϊ���������������Xԭ���뵪ԭ�Ӹ���֮��Ϊ4��1����XΪH��X��N�γ�笠����ӣ���϶�Ӧ���ʻ���������ʽ����⣮
����Y������������Ϊx����Ϊ��һ�����������x+x+1+x+1=17�����x=5��Y��Z��W��Ӧ������Ԫ�طֱ�ΪN��O��S����Ϊ�ڶ������������x+x+x+1=17��xΪ������������������Y��NԪ�أ�X��Y��Z��W�����һ�������ԭ�Ӹ���֮��Ϊ8��2��4��1������������ԭ������ԭ�Ӹ���֮��Ϊ1��4��Ϊ���������������Xԭ���뵪ԭ�Ӹ���֮��Ϊ4��1����XΪH��X��N�γ�笠����ӣ���϶�Ӧ���ʻ���������ʽ����⣮
��� �⣺X��Y��Z��W��HΪԭ������������������ֶ�����Ԫ�أ�Z��Y���ڣ�Z��WҲ���ڣ� Y��Z��W����Ԫ�ص�ԭ������������֮��Ϊ17����Y��Z��W���ߴ���ͬһ���ڻ�ͬһ���壬����������֮�Ͳ�����Ϊ17�����ڲ�ͬ���ڵ�Y��Z��W�������ڣ����ܳ��ֵ�λ�ù�ϵ�У�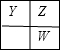
 ����Y������������Ϊx����Ϊ��һ�����������x+x+1+x+1=17����ã�x=5��Y��Z��W��Ӧ������Ԫ�طֱ�ΪN��O��S����Ϊ�ڶ������������x+x+x+1=17��xΪ������������������Y��NԪ�أ�X��Y��Z��W�����һ�������ԭ�Ӹ���֮��Ϊ8��2��4��1������������ԭ������ԭ�Ӹ���֮��Ϊ1��4��Ϊ���������������Xԭ���뵪ԭ�Ӹ���֮��Ϊ4��1����XΪH��X��N�γ�笠����ӣ�
����Y������������Ϊx����Ϊ��һ�����������x+x+1+x+1=17����ã�x=5��Y��Z��W��Ӧ������Ԫ�طֱ�ΪN��O��S����Ϊ�ڶ������������x+x+x+1=17��xΪ������������������Y��NԪ�أ�X��Y��Z��W�����һ�������ԭ�Ӹ���֮��Ϊ8��2��4��1������������ԭ������ԭ�Ӹ���֮��Ϊ1��4��Ϊ���������������Xԭ���뵪ԭ�Ӹ���֮��Ϊ4��1����XΪH��X��N�γ�笠����ӣ�
��1��Z��W��H�ֱ�ΪO��S��Cl����Ӧ���ӷֱ�ΪS2-��Cl-��O2-�����ӵĵ��Ӳ�Խ�࣬���Ӱ뾶Խ���Ӳ���ͬʱ�����ӵĺ˵����Խ�����Ӱ뾶ԽС�����������ӵ����Ӱ뾶��СΪ��S2-��Cl-��O2-��
�ʴ�Ϊ��S2-��Cl-��O2-��
��2��H�ĵ���Ϊ������W���⻯��Ϊ���⣬���������ⷴӦ���ɵ���ɫS��HCl��������˵��H��W���ʵ�������ǿ��Ϊ��Cl2��S��
�ʴ�Ϊ��Cl2��S��
��3��H�ĵ���Ϊ������ʵ�����ö���������Ũ���ᷴӦ���ȷ�Ӧ��ȡ��������Ӧ�Ļ�ѧ����ʽΪ��MnO2+4HCl ��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O��
�ʴ�Ϊ��MnO2+4HCl ��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O��
��4�����ݷ�����֪���û�����Ϊ��NH4��2SO4���������Һ�У�笠����Ӳ���ˮ�⣬��Һ�����ԣ���c��H+����c��OH-��������笠����ӵ�ˮ��̶Ƚ�С����c��NH4+����c��SO42-������Һ������Ũ�ȴ�СΪ��c��NH4+����c��SO42-����c��H+����c��OH-����
�ʴ�Ϊ��c��NH4+����c��SO42-����c��H+����c��OH-����
���� ���⿼����λ�ýṹ�����ʹ�ϵ���ۺ�Ӧ�ã���Ŀ�Ѷ��еȣ��ƶ�Ԫ��Ϊ���ؼ����漰���Ӱ뾶�Ƚϡ���ѧ����ʽ��д������Ũ�ȴ�С�Ƚϵ�֪ʶ��ע����������ԭ�ӽṹ��Ԫ�������ɡ�Ԫ�����ڱ��Ĺ�ϵ������������ѧ���ķ���������������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʵ���ҿ����ű���ʳ��ˮ�ķ����ռ����� | |
| B�� | �Ӵ�����ʹN2��H2��һ��������ת��ΪNH3 | |
| C�� | ����ˮƿ�������д����������ݳ� | |
| D�� | Fe��SCN��3��Һ�м���6mol/LNaOH��Һ����ɫ��dz |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | �� | �� | �� | �� |
| ����װ�� | 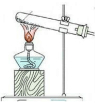 |  |  |  |
| ��ѡ�Լ� | NaHSO3���� | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | 70%H2SO4+K2SO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
| Ԫ�ر�� | Ԫ��������Ϣ |
| A | �䵥�����ܶ���С������ |
| B | �����Ӵ�������λ����ɣ������ǿ�������Ҫ�ɷ�֮һ |
| C | ����������B������������ͬ�ĵ��Ӳ�ṹ������B�����γ��������ӻ����� |
| D | ����������������ﶼ�����ԣ���Cͬ���� |
| E | ��Cͬ���ڣ�ԭ�Ӱ뾶�ڸ�������С |
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
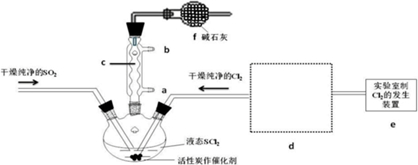
 ��ͼΪʵ������ȡ��������������װ��ͼ�����й��ڸ�ʵ��������У�����ȷ���ǣ�������
��ͼΪʵ������ȡ��������������װ��ͼ�����й��ڸ�ʵ��������У�����ȷ���ǣ�������| A�� | ��a�Թ����ȼ����Ҵ���Ȼ���ҡ���Թܱ���������Ũ���ᣬ�ټӱ����� | |
| B�� | �Թ�b�е������¶˹ܿڲ��ܽ���Һ���ԭ���Ƿ�ֹʵ������з����������� | |
| C�� | ʵ��ʱ�Թ�b�б���Na2CO3��Һ�������������Ҵ����к����ἰ���������������ܽ�ȱ��ڷֲ� | |
| D�� | ����������ֻ�е��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
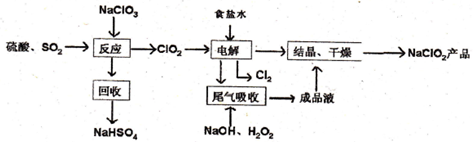
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com