
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 由水电离产生的C(H+) = 10-13mol/L的溶液中:K+、Na+、SO32-、S2-
B.1.0 mol·L-1KNO3溶液:H+、Fe2+、Cl-、SO42-
C. 的溶液:K+、Ba2+、NO3-、AlO-2
的溶液:K+、Ba2+、NO3-、AlO-2
D.过量氨水中:Ag+、Na+、K+、NO- 3
科目:高中化学 来源:2015届江西省红色六校高三第一次联考化学试卷(解析版) 题型:选择题
下列各组离子能大量共存,向溶液中通入足量相应气体后,各离子还能大量存在的是
A.氯气:K+ Ba2+ SiO32- NO3- B.二氧化硫:Na+ NH4+ SO32- C1-
C.氨气:K+ Na+ AlO2-. CO32- D.甲醛:Ca2+ Mg2+ MnO4- NO3-
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三第二次月考化学试卷(解析版) 题型:选择题
饱和氯水与石灰石反应是制取较浓HClO溶液的方法之一。某兴趣小组进行了如下实验探究①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水(如下图所示),充分反应,有少量气泡产生,溶液浅黄绿色褪去;②过滤,将滤液滴在有色布条上,发现滤液比氯水的漂白性更强;③为了确定反应产物,将滤液分为三份,分别进行以下实验:第一份与石灰水混合,立即产生大量白色沉淀;第二份与稀盐酸混合,立即产生大量无色气体;第三份滤液加热,看到滤液变浑浊且有大量无色气体产生。经检测,上述实验中产生的无色气体均为CO2 。依据上述实验可推知:滤液中的溶质除CaCl2、HClO外,还有
A.Ca (ClO)2 B.CaCO3 C.Ca(HCO3)2 D.CaO
查看答案和解析>>
科目:高中化学 来源:2015届江西省新余市高三第二次模拟考试化学试卷(解析版) 题型:选择题
将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是
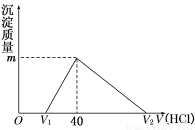
A.原合金质量为0.92 g B.标准状况下产生氢气896 mL
C.图中V2为60 mL D.图中m值为1.56 g
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:实验题
(14分)固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO2)2 、 NO2 、 O2 乙:MgO 、 NO2 、 O2
丙:Mg3N2 、 O2 丁:MgO 、 NO2 、 N2
(1)实验前,小组成员经讨论认定猜想丁不成立,理由是 。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):

(2)实验过程
①仪器连接后,放入固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E 中有气泡连续放出,表明 。
②称取Mg(NO3)2固体3 .79 g置于A中,加热前通入N2以驱尽装置内的空气,其目的是 ;关闭K,用酒精灯加热时,正确操作是先 ,然后固定在管中固体部位下加热。
③观察到A 中有红棕色气体出现,C、D 中未见明显变化。
④待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1.0g
⑤取少量剩余固体于试管中,加入适量水,未见明显现象。
(3)实验结果分析讨论
①根据实验现象和剩余固体的质量经分析可初步确认猜想 是正确的。
②根据D 中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应: (填写化学方程式),溶液颜色会褪去;小组讨论认定分解产物中有O2存在,未检测到的原因是 。(用化学方程式表示)
③小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步研究。
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
将两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO42-,若将2.83 g X中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-可和过量KI溶液反应,得到3.81 g I2,反应的离子方程式为:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,若向溶有2.83 g X的溶液中,加入过量的BaCl2溶液,可得到4.66 g白色沉淀。由此可推断出X的化学式为
A.K2SO4·2Cr2(SO4)3
B.2K2SO4·Cr2(SO4)3
C.K2SO4·1/2Cr2(SO4)3
D.K2SO4·Cr2(SO4)3
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+===Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol。下列说法正确的是( )
A.反应中硫元素被氧化,所有铁元素均被还原
B.氧化剂是Fe3+,氧化产物是Cu2+
C.反应中转移电子的物质的量为x mol
D.反应结束后,测得溶液中三种金属离子的总物质的量为y mol,则原Fe3+的总物质的量为(y-x)mol
查看答案和解析>>
科目:高中化学 来源:[同步]2015年课时练(鲁科版必修2)课时6元素周期表、元素周期律(解析版) 题型:填空题
氧族元素(ⅥA族)的各种性质可归纳整理如下(部分):
元素 性质 | 8O | 16S | 34Se(硒) | 52Te(碲) |
单质沸 点(℃) | -183 | 444.6 | 685 | 1 390 |
主要 化合价 | -2 | -2,+4, +6 | -2,+4, +6 |
|
原子半 径(nm) | 0.074 | 0.102 | 0.116 | 0.143 |
单质与 H2反应 | 点燃易 化合 | 加热化合 | 加热 难化合 | 不能直 接化合 |
回答下列问题:
(1)氧原子的结构示意图为________,硫离子的结构示意图为________。
(2)碲的主要化合价可能有________。
(3)氧元素比硫元素的非金属性________(填“强”或“弱”)。请用化学方程式证明该结论:__________________________________________________________。
(4)H2O2被Cl2氧化生成O2,H2O2经常作脱氯剂,用于消除水中的Cl2,写出该反应的化学方程式:___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com