
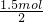 =0.75mol,剩余的(x-0.75)mol氯气氧化Br-,由电子转移守恒可知,能氧化Br-为2(x-0.75)mol.根据反应后溶液中C1-与Br-的个数比为8:1,列方程计算X中,据此判断.
=0.75mol,剩余的(x-0.75)mol氯气氧化Br-,由电子转移守恒可知,能氧化Br-为2(x-0.75)mol.根据反应后溶液中C1-与Br-的个数比为8:1,列方程计算X中,据此判断.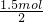 =0.75mol,所以剩余的(x-0.75)mol氯气氧化Br-,由电子转移守恒可知,能氧化Br-为2(x-0.75)mol.
=0.75mol,所以剩余的(x-0.75)mol氯气氧化Br-,由电子转移守恒可知,能氧化Br-为2(x-0.75)mol.

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案科目:高中化学 来源:吉林省长春市2011届度高三上学期期中考 题型:选择题
下列叙述正确的是( )
A.阳离子只有氧化性,阴离子只有还原性
B.含氧酸可作氧化剂而无氧酸不能
C.工艺师利用盐酸刻蚀石英制作艺术品
D.已知还原性:Fe2+>Br-可知反应2Fe3++2Br-=2Fe2++Br2不易进行
查看答案和解析>>
科目:高中化学 来源:2010-2011学年陕西省高三上学期期中考试化学卷 题型:选择题
下列叙述正确的是( )
A.阳离子只有氧化性,阴离子只有还原性
B.含氧酸可作氧化剂而无氧酸不能
C.工艺师利用盐酸刻蚀石英制作艺术品
D.已知还原性:Fe2+>Br-可知反应2Fe3++2Br-=2Fe2++Br2不易进行
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.阳离子只有氧化性,阴离子只有还原性 |
| B.含氧酸可作氧化剂而无氧酸不能 |
| C.在8NH3+3Cl2═N2+6NH4Cl反应中,氧化剂与还原剂物质的量之比是2:3 |
| D.已知还原性:Fe2+>Br-,可知反应2Fe3++2Br-═2Fe2++Br2不易进行 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省洛阳一中高一(上)周练化学试卷(11月份)(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com