
【题目】室温下,向20 mL l mol/L的某二元弱酸H2X溶液中逐渐加入NaOH固体(忽略溶液温度及体积变化),测得溶液中的H2X、HX-、X2-的物质的量浓度与溶液pH变化关系如图。下列叙述错误的是( )
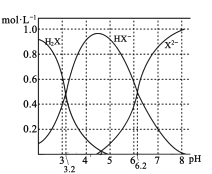
A.NaHX的水溶液呈酸性
B.当加入NaOH固体0.01 mol时,溶液pH= 3.2
C.当加入NaOH固体0.02 mol时,溶液中的离子浓度大小关系为:c(Na+)>c(HX-)>c(H+)>c(X2-)> c(OH-)
D.当加入NaOH固体0.04 mol时,溶液中水的电离程度最大
【答案】B
【解析】
A. 由H2X和HX-曲线的相交点可知,酸的Ka1=1.0×10-3.2,由X-与HX-曲线的相交点可知酸的Ka2=1.0×10-6.2,可以计算NaHX的水解平衡常数Kh=Kw/ Ka1=1.0×10-10.8<Ka1,所以NaHX的水解小于其HX-的电离,从而NaHX的水溶液呈酸性,A正确;
B. 当加NaOH固体0.01mol时,溶液中的溶质为H2X和NaHX,两者的浓度相同,但因H2X的电离大于NaHX的水解,所以溶液中H2X与HX-的浓度并不相同,且H2X的电离大于HX-的水解,所以溶液pH>3.2,B错误;
C. 当加入NaOH固体0.02mo时,溶液溶质即为NaHX,因HX-的电离大于HX-的水解,所以c(Na+)>c(HX-)>c(H+)>c(X2-)>c(OH-),C正确
D. 当加入NaOH固体0.04mol时,液的溶质为Na2X,水解能力最强,水的电离程度最大D正确;故答案为:B。


科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
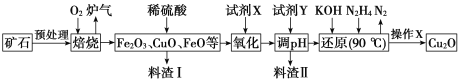
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(1)炉气中的有害气体成分是___________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为___________。
(2)试剂X是H2O2溶液,当试剂X是___________时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是________。
(4)“还原”步骤中为提高N2H4转化率可采取的措施有_________(填序号)。
a.不断搅拌,使N2H4和溶液充分接触 b.增大通入N2H4的流速
c.减少KOH的进入量 d.减小通入N2H4的流速
(5)写出用N2H4制备Cu2O的化学方程式为_______________
(6)操作X包括烘干,其中烘干时要隔绝空气,其目的是____________。
(7)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式为________
(8)工业上用氨气生产氢氰酸(HCN的反应为:CH4(g)+NH3(g)HCN(g)+3H2(g ) △H>0。其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。则X可以是___________(填字母序号)
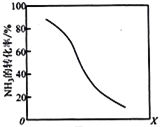
a.温度 b.压强 c.催化剂 d.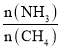
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 C时,H2SO3的pKa1、pKa2(pK= -lgK)分别为1.89、7.20, NH3·H2O的pKb为4.72。常温时,下列指定溶液中粒子物质的量浓度关系正确的是
A.pH=3的H2SO3溶液中,c(HSO3 -) +2c(SO3-)=1 ×10-3 mol·L-1
B.0.1 mol·L-1H2SO3溶液用NaOH溶液滴定至pH =7.20, c( HSO3 ) =2c(SO3- )
C.0.1 mol.L-1H2SO3溶液用氨水滴定至pH=7.0, c(NH4+) =c(HSO3-) +c(SO32- )
D.0.1 mol·L-1NH4HSO3溶液中: c(NH4+ ) >c(H+) >c( NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制物质的量浓度为0.1 mol·L-1的Na2CO3溶液100 mL时,下列操作正确的是( )
A. 用托盘天平称取1.06 g无水碳酸钠,在烧杯中加适量水溶解,待冷却到室温后,将溶液转移到容量瓶中
B. 在使用容量瓶前必须检查容量瓶是否完好以及瓶塞处是否漏水
C. 定容时,若加水超过刻度线,可用胶头滴管小心吸出多余部分
D. 定容时,若仰视,则所配溶液的浓度将偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.检验FeCl3溶液中是否含有Fe2+,可向溶液中加入酸性高锰酸钾溶液,观察溶液是否褪色
B.己知:2CH2=CH2+O2![]() 2
2 ![]() ,该反应的反应类型为氧化反应
,该反应的反应类型为氧化反应
C.己知Ksp(BaCO3)=2.58×10-9,Ksp(BaSO4)=1.1×10-10,所以碳酸钡的溶解度一定大于硫酸钡
D.用裂化汽油萃取溴水中的溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.3 mol·L-1硫酸溶液480 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图是已提供仪器,配制上述溶液均需用到的玻璃仪器是________(填选项)。
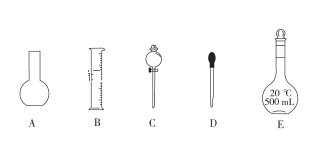
(2) 下列操作会使配制的NaOH溶液浓度偏低的是__________。
A 称量NaOH所用砝码生锈
B 选用的容量瓶内有少量蒸馏水
C 定容摇匀后,液面下降,又加水至刻度线
D 定容时俯视刻度线
(3)根据计算用托盘天平称取NaOH的质量为________g。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为__________mL(计算保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法错误的是
A.常温常压下,4gD2O中含有的电子数为2NA
B.42gC2H4和C4H8的混合气中含有氢原子数为6NA
C.H2O(g)通过Na2O2(s)使其增重bg时,反应中转移的电子数为![]()
D.25℃时,1LpH=1的HCl溶液中含有的H原子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是
A.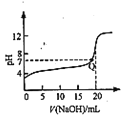 是常温下用0.1000 mol/LNaOH溶液滴定20.000mL 0.l000 mol/L CH3COOH的滴定曲线,说明Q点表示酸碱中和滴定终点
是常温下用0.1000 mol/LNaOH溶液滴定20.000mL 0.l000 mol/L CH3COOH的滴定曲线,说明Q点表示酸碱中和滴定终点
B.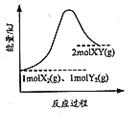 是1mol X2(g)、Imol Y2(g)反应生成2mol XY(g)的能量变化曲线,说明反应物所含化学键的键能总和大于生成物所含化学键的键能总和
是1mol X2(g)、Imol Y2(g)反应生成2mol XY(g)的能量变化曲线,说明反应物所含化学键的键能总和大于生成物所含化学键的键能总和
C.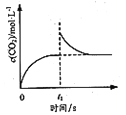 是恒温密闭容器中发生CaCO3(s) = CaO(s)+CO2(g)反应时C(CO2)随反应时间变化的曲线,说明t1时刻改变的条件可能是缩小容器的体积
是恒温密闭容器中发生CaCO3(s) = CaO(s)+CO2(g)反应时C(CO2)随反应时间变化的曲线,说明t1时刻改变的条件可能是缩小容器的体积
D.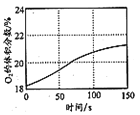 是光照盛有少量氯水的恒容密闭容器时容器内O2的体积分数变化曲线,说明光照氯水有O2生成
是光照盛有少量氯水的恒容密闭容器时容器内O2的体积分数变化曲线,说明光照氯水有O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是几种苯的同系物,回答下列问题:
①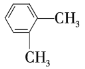 ②
②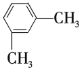 ③
③![]() ④
④![]() ⑤
⑤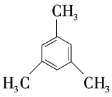 ⑥
⑥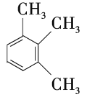 ⑦
⑦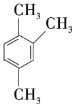
(1)①②③之间的关系是______。
(2)按习惯命名法命名,②的名称为______;按系统命名法命名,③⑥的名称分别为______、______。
(3)以上7种苯的同系物中苯环上的一氯代物只有一种的是______(填序号),④苯环上的一氯代物有______种。
(4)④的同分异构体有多种,除⑤⑥⑦外,写出苯环上一氯代物有2种,且与④互为同分异构体的有机物的结构简式:______,它的系统名称为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com